
題目列表(包括答案和解析)
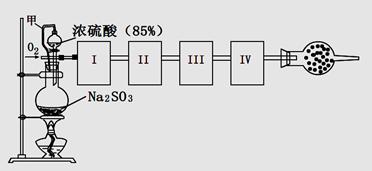
測定生成SO3的轉化率可以用下圖裝置,裝置中燒瓶內發生的化學反應方程式為:Na2SO3(s)+H2SO4(85%)=Na2SO4+H2O+SO2↑(已知SO3的熔點是16.8oC,沸點是44.8oC)
(1)裝置中甲管的作用是__________________。
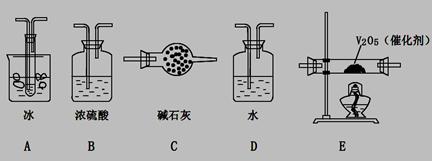
(2)根據實驗需要,應該在I、II、III、IV處連接合適的裝置,請從下圖A?E裝置中選擇最適合裝置并將其序號填至下面的空格中,每個裝置不重復使用。
I、 II、III、IV處連接的裝置分別是 。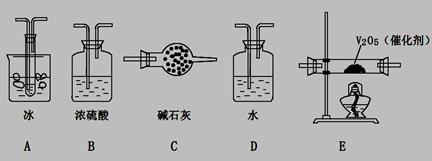
(3)為使SO2有較高的轉化率,實驗中加熱催化劑與滴加濃硫酸的順序中,應采取的操作是____________ ,若用大火加熱燒瓶時,SO2的轉化率會____________ (填“升高”、“不變”或“降低”)。
(4)有一小組在實驗中發現,SO2氣體產生緩慢,以致后續實驗現象不明顯,但又不存在氣密性問題,請你推測可能的原因(可以不填滿)①原因:______ ②原因 :______ ③原因:______
(5)將SO2通入含1mol氯酸的溶液中,可生成一種強酸和一種氧化物,并有6.02×1023個電子轉移,則該反應的化學方程式為
(6)用n mol Na2SO3粉末與足量濃硫酸進行此實驗,當反應結束時,繼續通入O2一段時間后,測得裝置IV增重了 mg,則實驗中SO2的轉化率為 。(用含m、n的代數式填寫)
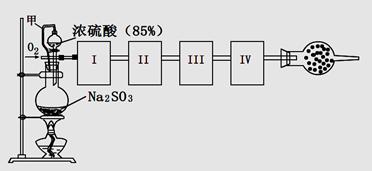
測定生成SO3的轉化率可以用下圖裝置,裝置中燒瓶內發生的化學反應方程式為:Na2SO3(s)+H2SO4(85%)=Na2SO4+H2O+SO2↑(已知SO3的熔點是16.8oC,沸點是44.8oC)
(1)裝置中甲管的作用是__________________。
(2)根據實驗需要,應該在I、II、III、IV處連接合適的裝置,請從下圖A?E裝置中選擇最適合裝置并將其序號填至下面的空格中,每個裝置不重復使用。
I、 II、III、IV處連接的裝置分別是 。
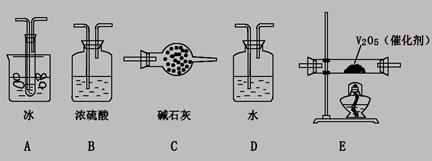
(3)為使SO2有較高的轉化率,實驗中加熱催化劑與滴加濃硫酸的順序中,應采取的操作是____________ ,若用大火加熱燒瓶時,SO2的轉化率會____________ (填“升高”、“不變”或“降低”)。
(4)有一小組在實驗中發現,SO2氣體產生緩慢,以致后續實驗現象不明顯,但又不存在氣密性問題,請你推測可能的原因(可以不填滿)①原因:______ ②原因 :______ ③原因:______
(5)將SO2通入含1mol氯酸的溶液中,可生成一種強酸和一種氧化物,并有6.02×1023個電子轉移,則該反應的化學方程式為
(6)用n mol Na2SO3粉末與足量濃硫酸進行此實驗,當反應結束時,繼續通入O2一段時間后,測得裝置IV增重了 mg,則實驗中SO2的轉化率為 。(用含m、n的代數式填寫)
化學反應原理對于工業生產和科研有重要意義
I、下列三個化學反應的平衡常數(K1、K2、K3)與溫度的關系分別如下表所示:
| 化學反應 | 平衡常數 | 溫度 | |
| 973 K | 1173 K | ||
①Fe(s)+CO2(g) FeO(s)+CO(g) FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) FeO(s)+H2(g) FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
③CO(g) +H2O(g) CO2(g) +H2(g) CO2(g) +H2(g) | K3 | ? | ? |




1
2
3
4
5
6
C
B
D
D
D
C
7
8
9
10
11
12
C
B
C
B
A
C
13
14
15
16
17
18
B
B
D
A
C
A
19
20
21
22
23
24
A
D
B
A
D
B
25、氧化劑:KMnO4 還原劑:HCl 質量比:316∶511
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com