
題目列表(包括答案和解析)

(1)當加入B溶液110 mL時,溶液中的沉淀是_____________(填化學式)。
(2)溶液B中Na2SO4與NaOH的物質的量濃度之比為_____________;從90 mL—100 mL之間加入10 mL B溶液時發生的離子反應方程式是___________________________。
(3)將A、B溶液中各溶質的物質的量濃度填入下表:
溶質 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
濃度/(mol·L-1) |
|
|
|
|
|
向100 mL BaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,產生沉淀的總物質的量和加入混合溶液B的體積關系如圖所示:
(1)當加入B溶液110 mL時,溶液中的沉淀是 。(填化學式)
(2)從90 mL至100 mL之間加入10 mLB溶液時,由圖像縱坐標不變可知此段發生反應的離子方程式是:① ;② ;并由此可以分析出溶液B中Na2SO4與NaOH物質的量濃度之比為 。
(3)通過計算分析可知:
B溶液中NaOH物質的量濃度為 mol/L;
A溶液中FeCl3物質的量濃度為 mol/L。
向100 mL BaCl2、AlCl3、FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,產生沉淀的總物質的量和加入混合溶液B的體積關系如圖所示:
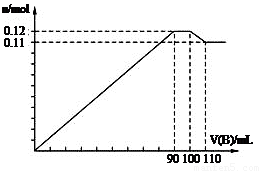
(1)當加入B溶液110 mL時,溶液中的沉淀是 。(填化學式)
(2)從90 mL至100 mL之間加入10 mLB溶液時,由圖像縱坐標不變可知此段發生反應的離子方程式是:① ;② ;并由此可以分析出溶液B中Na2SO4與NaOH物質的量濃度之比為 。
(3)通過計算分析可知:
B溶液中NaOH物質的量濃度為 mol/L;
A溶液中FeCl3物質的量濃度為 mol/L。


1.C 2.C 3.D 4.B 5.B 6.A 7.AD 8.AC 9.BD 10.AC 11.C
12.D 13.AC 14.D 15.B 16.D 17.B 18.B 19.A 20.D 21.D 22.B
23.(1) ;
; ;生成了弱電解質
;生成了弱電解質 ,破壞了
,破壞了 的溶解平衡.
的溶解平衡.
(2)①


②
24.(1) 在溶液中存在
在溶液中存在 的電離,
的電離,

 ,同時還存在
,同時還存在 離子的水解,
離子的水解,

 ,
, 溶液呈弱堿性,說明
溶液呈弱堿性,說明 的水解反應占優勢.
的水解反應占優勢.
(2) 在溶液中存在著
在溶液中存在著 離子的電離,同時又存在
離子的電離,同時又存在 離子的水解,
離子的水解, 呈弱酸性說明
呈弱酸性說明 離子的電離比水解來得強.
離子的電離比水解來得強.
(3)
25.A: B:
B: C:
C: D:
D: E:
E:
① ②
② ③
③
④
26.(1)粉紅 


(2)放出氣體,溶液變渾濁,紅色加深紅

27.(1)溶液變成紫紅色,0.25 (2) ,
, w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
28.(1)硫 (2) ;
;
(3) ,可能含有
,可能含有 (4)
(4) 、
、 、
、 、
、 和
和 、
、 和
和
(5) 、
、 、
、
29.解析:①溶液中 被完全沉淀出后,
被完全沉淀出后, 才開始沉淀.圖中曲線第二段為平行直線,沉淀總物質的量沒有增減.故這段是因
才開始沉淀.圖中曲線第二段為平行直線,沉淀總物質的量沒有增減.故這段是因 的溶解和
的溶解和 的繼續生成導致,且溶解的
的繼續生成導致,且溶解的 的物質的量和生成的
的物質的量和生成的 物質的量相等.故加入的物質:
物質的量相等.故加入的物質:
 這段的離子方程式為:
這段的離子方程式為:


②第一段生成的沉淀為 、
、 和
和 ,且B為90 mL時,
,且B為90 mL時, 、
、 恰好沉淀完全.這段反應的離子方程式為:
恰好沉淀完全.這段反應的離子方程式為: ,
,
 ,
,
③圖中曲線第三段(100-110 mL),B為100 mL時 恰好沉淀完全.這段中
恰好沉淀完全.這段中 繼續溶解,B為110 mL時,沉淀中
繼續溶解,B為110 mL時,沉淀中 已完全溶解.這段中溶解了
已完全溶解.這段中溶解了 ,消耗了10 mL NaOH,故
,消耗了10 mL NaOH,故 ,則100 mL時,共加入
,則100 mL時,共加入 為0.1 mol,共生成
為0.1 mol,共生成 ,故A溶液中
,故A溶液中 .這段
.這段 溶解的離子方程式為:
溶解的離子方程式為:
④圖中曲線第四段中,沉淀為 、
、 共0.11 mol,則
共0.11 mol,則
 為0.11 mol,A中
為0.11 mol,A中 .
.
⑤第二、三段間共消耗 ,則共溶解的
,則共溶解的 為0.02 mol,則A中
為0.02 mol,則A中 .w.w.w.k.s.5.u.c.o.m
.w.w.w.k.s.5.u.c.o.m
30.(1) ;
;
(2) ;
; ;
; ,
,

(3) ;
; ;
; ,
,
(4) ;
;
(5)
(6)
 www.ks5u.com
www.ks5u.com
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com