
題目列表(包括答案和解析)
|
下列離子方程式,正確的是 | |
A. |
在溶液中亞硫酸氫銨與等物質的量氫氧化鈉混合
|
B. |
碳酸鈉溶液中加入二氧化硅: |
C. |
二氧化硅與燒堿溶液反應:SiO2+2OH-
|
D. |
硅酸與燒堿溶液中和:H2SiO3+2OH-
|
下列兩題分別對應于“物質結構與性質”和“實驗化學”兩個選修課程模塊的內容,請你選擇其中一題作答,如果兩題全做,則按A題評分。
A.(12分)【物質結構與性質】
1915年諾貝爾物理學獎授予Henry Bragg和Lawrence Bragg,以表彰他們用X射線對晶體結構的分析所作的貢獻。
⑴科學家通過X射線探明,NaCl、KCl、MgO、CaO晶體結構相似,其中三種晶體晶格能數據如下表:
| 晶體 | NaCl | KCl | CaO |
| 晶格能/(kJ·mol-1) | 786 | 715 | 3 401 |
4種晶體NaCl、KCl、MgO、CaO熔點由高到低的順序是 ▲ 。
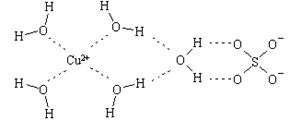
⑵科學家通過X射線推測膽礬中既含有配位鍵,又含有氫鍵,其結構示意圖可簡單表示如下,其中配位鍵和氫鍵均采用虛線表示。

①寫出基態Cu原子的核外電子排布式 ▲ ;金屬銅采用下列 ▲ (填字母代號)堆積方式。
 |
A B C D
②寫出膽礬晶體中水合銅離子的結構簡式(必須將配位鍵表示出來) ▲ 。
③水分子間存在氫鍵,請你列舉兩點事實說明氫鍵對水的性質的影響 ▲ 。
④SO42-的空間構型是 ▲ 。
B.(12分)【實驗化學】
硫酸亞鐵銨的化學式為(NH4)2SO4·FeSO4·6H2O,又名莫爾鹽,是分析化學中常見的還原劑。某化學研究小組設計如下實驗來制備莫爾鹽并測定硫酸亞鐵銨的純度。
步驟一:鐵屑的處理與稱量。在盛有適量鐵屑的錐形瓶中加入Na2CO3溶液,加熱,過濾、洗滌、干燥、稱量,質量記為m1。
步驟二:FeSO4的制備。將上述鐵屑加入到一定量的稀H2SO4中,充分反應后過濾并用少量熱水洗滌錐形瓶和濾紙。濾液及洗滌液完全轉移至蒸發皿中。濾渣干燥后稱重,質量記為m2。
步驟三:硫酸亞鐵銨的制備。準確稱取所需質量的(NH4)2SO4加入“步驟二”中的蒸發皿中,緩緩加熱一段時間后停止,冷卻,待硫酸亞鐵銨結晶后過濾。晶體用無水乙醇洗滌并自然干燥,稱量所得晶體質量。
步驟四:用比色法測定硫酸亞鐵銨的純度。
 回答下列問題:
回答下列問題:
⑴步驟三中稱取的(NH4)2SO4質量為 ▲ 。
⑵①鐵屑用Na2CO3溶液處理的目的是 ▲ 。制備FeSO4溶液時,用右圖裝置趁熱過濾,原因是 ▲ 。
②將(NH4)2SO4與FeSO4混合后加熱、濃縮,停止加熱的時機是 ▲ 。
③比色法測定硫酸亞鐵銨純度的實驗步驟為:Fe3+標準色階的配制、待測硫酸亞鐵銨溶液的配制、比色測定。標準色階和待測液配制時除均需加入少量稀HCl溶液外,還應注意的問題是 ▲ 。
④該實驗最終通過 ▲ 確定硫酸亞鐵銨產品等級。

| 晶體 | NaCl | KCl | CaO |
| 晶格能/(kJ·mol-1) | 786 | 715 | 3 401 |
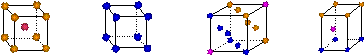 |
下列反應的離子方程式正確的是 ( )
A.過量二氧化碳通入偏鋁酸鈉溶液中:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
B.在溶液中亞硫酸氫銨與等物質的量氫氧化鈉混合:
NH4+ HSO3- +2OH-=SO32- +NH3↑+2H2O
C.氯氣通入冷的燒堿溶液中:2Cl2+2OH-=3Cl-+ClO-+H2O
D.碳酸氫鎂溶液中加入過量的石灰水:
Mg2++2HCO3- +Ca2+ +2OH-=CaCO3↓+2H2O+MgCO3↓
1.C 2.C 3.D 4.B 5.B 6.A 7.AD 8.AC 9.BD 10.AC 11.C
12.D 13.AC 14.D 15.B 16.D 17.B 18.B 19.A 20.D 21.D 22.B
23.(1) ;
; ;生成了弱電解質
;生成了弱電解質 ,破壞了
,破壞了 的溶解平衡.
的溶解平衡.
(2)①


②
24.(1) 在溶液中存在
在溶液中存在 的電離,
的電離,

 ,同時還存在
,同時還存在 離子的水解,
離子的水解,

 ,
, 溶液呈弱堿性,說明
溶液呈弱堿性,說明 的水解反應占優勢.
的水解反應占優勢.
(2) 在溶液中存在著
在溶液中存在著 離子的電離,同時又存在
離子的電離,同時又存在 離子的水解,
離子的水解, 呈弱酸性說明
呈弱酸性說明 離子的電離比水解來得強.
離子的電離比水解來得強.
(3)
25.A: B:
B: C:
C: D:
D: E:
E:
① ②
② ③
③
④
26.(1)粉紅 


(2)放出氣體,溶液變渾濁,紅色加深紅

27.(1)溶液變成紫紅色,0.25 (2) ,
, w.w.w.k.s.5.u.c.o.m
w.w.w.k.s.5.u.c.o.m
28.(1)硫 (2) ;
;
(3) ,可能含有
,可能含有 (4)
(4) 、
、 、
、 、
、 和
和 、
、 和
和
(5) 、
、 、
、
29.解析:①溶液中 被完全沉淀出后,
被完全沉淀出后, 才開始沉淀.圖中曲線第二段為平行直線,沉淀總物質的量沒有增減.故這段是因
才開始沉淀.圖中曲線第二段為平行直線,沉淀總物質的量沒有增減.故這段是因 的溶解和
的溶解和 的繼續生成導致,且溶解的
的繼續生成導致,且溶解的 的物質的量和生成的
的物質的量和生成的 物質的量相等.故加入的物質:
物質的量相等.故加入的物質:
 這段的離子方程式為:
這段的離子方程式為:


②第一段生成的沉淀為 、
、 和
和 ,且B為90 mL時,
,且B為90 mL時, 、
、 恰好沉淀完全.這段反應的離子方程式為:
恰好沉淀完全.這段反應的離子方程式為: ,
,
 ,
,
③圖中曲線第三段(100-110 mL),B為100 mL時 恰好沉淀完全.這段中
恰好沉淀完全.這段中 繼續溶解,B為110 mL時,沉淀中
繼續溶解,B為110 mL時,沉淀中 已完全溶解.這段中溶解了
已完全溶解.這段中溶解了 ,消耗了10 mL NaOH,故
,消耗了10 mL NaOH,故 ,則100 mL時,共加入
,則100 mL時,共加入 為0.1 mol,共生成
為0.1 mol,共生成 ,故A溶液中
,故A溶液中 .這段
.這段 溶解的離子方程式為:
溶解的離子方程式為:
④圖中曲線第四段中,沉淀為 、
、 共0.11 mol,則
共0.11 mol,則
 為0.11 mol,A中
為0.11 mol,A中 .
.
⑤第二、三段間共消耗 ,則共溶解的
,則共溶解的 為0.02 mol,則A中
為0.02 mol,則A中 .w.w.w.k.s.5.u.c.o.m
.w.w.w.k.s.5.u.c.o.m
30.(1) ;
;
(2) ;
; ;
; ,
,

(3) ;
; ;
; ,
,
(4) ;
;
(5)
(6)
 www.ks5u.com
www.ks5u.com
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com