
題目列表(包括答案和解析)
已知①~④均為工業生產及應用的常見反應。其中常溫下B、D、J、P氣體,E為分子中原子個數比為1:l的液體。A的相對分子質量為120。(個別反應的產物已略去)

試回答下列問題:
(1)A的化學式為_____________ ;工業上反應①所用的設備名稱是_____________。
(2)反應②的實驗中,還需用到的藥品是_____________、_____________。
(3)反應④的化學方程式為_____________;
該反應裝置中使用陽離子交換膜的作用是______________________________________
______________________________________________________。
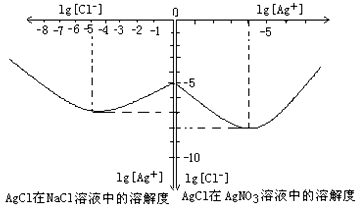
(4)P與N反應的產物之一能和K的溶液發生反應,有紅褐色沉淀生成。寫出該產物
與K以物質的量按1:2反應的離子方程式:__________________________。
(5)硫酰氯(![]() )是制造藥物、染料、表面活性劑的主要原料。可由下列反應制取:
)是制造藥物、染料、表面活性劑的主要原料。可由下列反應制取:
![]()
某學習小組認為,工業上為提高反應速率和![]() 的產率,可采取下列兩種方法:
的產率,可采取下列兩種方法:
I.不斷移走![]()
Ⅱ.采用高溫
請你就生產實際對上述兩種方案進行簡要評價,說明是否合理及原因。
 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1 2SO2+O2 在550 ℃時的平衡常數K=_________。 A、B表示不同壓強下的平衡轉化率,通常工業生產中采用常壓的原因是:__________________,并比較不同壓強下的平衡常數:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃時的平衡常數K=_________。 A、B表示不同壓強下的平衡轉化率,通常工業生產中采用常壓的原因是:__________________,并比較不同壓強下的平衡常數:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。 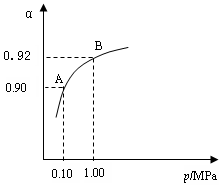
 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1 2SO2+O2 在550 ℃時的平衡常數K=_________。 A、B表示不同壓強下的平衡轉化率,通常工業生產中采用常壓的原因是:__________________,并比較不同壓強下的平衡常數:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃時的平衡常數K=_________。 A、B表示不同壓強下的平衡轉化率,通常工業生產中采用常壓的原因是:__________________,并比較不同壓強下的平衡常數:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。 

(9分)工業上以黃鐵礦為原料生產硫酸,其中重要的一步是催化氧化(生產中保持恒溫恒容條件):2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
(1)生產中為提高反應速率和SO2的轉化率,下列措施可行的是 。
A.向裝置中充入O2 B.升高溫度
C.向裝置中充入N2 D.向裝置中充入過量的SO2
(2)恒溫恒壓,通入3mol SO2和2mol O2 及固體催化劑,平衡時容器內氣體體積為起始時的90%。保持同一反應溫度,在相同容器中,將起始物質的量改為 5mol SO2(g)、3.5 mol O2(g)、1mol SO3(g),下列說法正確的是
A.第一次平衡時反應放出的熱量為294.9kJ
B.兩次平衡SO2的轉化率相等
C.兩次平衡時的O2體積分數相等
D.第二次平衡時SO3的體積分數等于2/9
(3)500 ℃時將10 mol SO2和5.0 mol O2置于體積為1L的恒容密閉容器中,SO2轉化為SO3的平衡轉化率為0.95。則500℃時的平衡常數K= 。
(4)550 ℃,A、B表示不同壓強下的平衡轉化率(如圖),通常工業生產中采用常壓的原因是 ,
并比較不同壓強下的平衡常數:K(0.10 MPa) K(1.0 MPa)。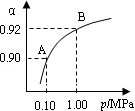
6、B 7、C 8、A 9、D 10、B 11、D 12、A 13、C
26 . ( 13 分) ( 1 ) y的電子式:  ( 2 分) 非極性( l 分)
( 2 分) 非極性( l 分)
( 2 ) 87 ( l 分)
( 3 ) C ( 1 分)
( 4 )堿( 1 分) NH3?H2O  NH4+ + OH一(2分)
NH4+ + OH一(2分)
CO32― + H2O  HCO3― + OH一( 2 分)
HCO3― + OH一( 2 分)
( 5 ) 2NH3 一 6e一+ 6OH― == N2 + 6H2O ( 2 分) 減小( 1 分)
27 . ( 16 分)

( 2 ) ① ⑥ (各 1 分,共 2 分。答 ③ 不扣分,其余有錯扣 1 分)
( 3 )羥基( l 分)羧基( 1 分)


28 . ( 16 分) ( 1 ) FeS2 ( 2 分) 沸騰爐(1分)
( 2 )氯酸鉀(或KClO3)( 1 分) 鎂條(或 Mg ) ( 1 分)

防止產生的Cl2和H2混和發生爆炸( l 分),避免Cl2和NaOH反應,使生成的 NaOH不純( 1 分)
( 4 ) 6Fe2+ +3ClO一+ 3 H2O == 2Fe(OH)3↓+3Cl―+ 4Fe3 + ( 2分)
( 5 ) I.不合理( 1 分),因為 SO2Cl2為液體,移走 SO2Cl2對反應體系中壓強和氣體濃度的影響不大(或對反應速率和 SO2Cl2的產率影響不大) ( l 分)
II.不合理( 1 分),該反應為放熱反應,升高溫度會降低 SO2Cl2的產率,但溫度過低,反應速率很小,經濟效益較低。因此,應選擇適當的溫度。( 2 分)
29.( 15 分)
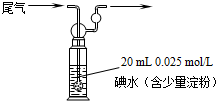
( 1 )增大銅粉與氧接觸面積, 使反應迅速、充分( 2 分)
( 2 ) N2 ( 1 分),排出 D中的空氣(1分) 關閉 k3( 1 分) 打開 kl、 k2 ( 1 分)
( 3 ) 錐形瓶中玻璃管液面上升( 1 分)
( 4 )Cu 十2NO3―+ 4H + === Cu 2+ + 2NO2↑+ 2H2O ( 2 分)
( 5 ) 向下調節量氣管(或及時關閉 k3 ) ( 1分,其它合理答案也可給分)
( 6 ) I . 0.0720 mol / L ( 2 分)
II.有( 1 分) E 裝置中生成 100 mL 、0.0720 mol / L硝酸時產生的NO 約為 80.6mL, 而試管中原有 50 mL N2,二者之和小于139.00 mL ,說明生成 NO2 的同時有 NO 生成( 2 分)。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com