
題目列表(包括答案和解析)
(16分)Fenton法常用于處理含難降解有機物的工業廢水。通常是在調節好pH和Fe2+濃度的廢水中加入H2O2,所產生的羥基自由基能氧化降解污染物。現運用該方法降解有機污染物p-CP,試探究有關因素對該降解反應速率的影響。實驗中控制p-CP的初始濃度相同,恒定實驗溫度在298K或313K(其余實驗條件見下表)設計如下對比實驗。
(1)請完成以下實驗設計表(將表中序號處應填內容)。
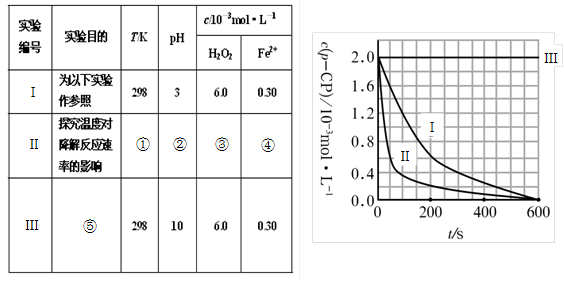
① ② ③ ④
⑤
(2)實驗測得p-CP的濃度隨時間變化的關系如右上圖所示。
a.請根據右上圖實驗Ⅰ曲線,計算降解反應在50—300s內的平均反應速率v(p-CP)= ,以及300s時p-CP的降解率為 ;
b.實驗Ⅰ、Ⅱ表明溫度升高,降解反應速率 (填“增大”、“減小”或“不變”);
c.實驗Ⅲ得出的結論是:pH=10時, ;
(3)可通過反應Fe3++ SCN— Fe(SCN)2+ 來檢驗反應是否產生鐵離子。已知在一定溫度下該反應達到平衡時c(Fe3+)=0.04 mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,則此溫度下該反應的平衡常數K= 。
(16分)Fenton法常用于處理含難降解有機物的工業廢水。通常是在調節好pH和Fe2+濃度的廢水中加入H2O2,所產生的羥基自由基能氧化降解污染物。現運用該方法降解有機污染物p-CP,試探究有關因素對該降解反應速率的影響。實驗中控制p-CP的初始濃度相同,恒定實驗溫度在298K或313K(其余實驗條件見下表)設計如下對比實驗。
(1)請完成以下實驗設計表(將表中序號處應填內容)。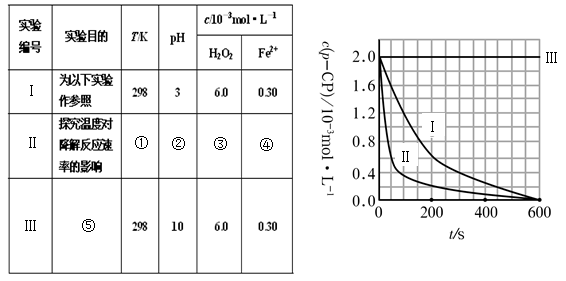
① ② ③ ④
⑤
(2)實驗測得p-CP的濃度隨時間變化的關系如右上圖所示。
a.請根據右上圖實驗Ⅰ曲線,計算降解反應在50—300s內的平均反應速率v(p-CP)= ,以及300s時p-CP的降解率為 ;
b.實驗Ⅰ、Ⅱ表明溫度升高,降解反應速率 (填“增大”、“減小”或“不變”);
c.實驗Ⅲ得出的結論是:pH=10時, ;
(3)可通過反應Fe3+ + SCN— Fe(SCN)2+ 來檢驗反應是否產生鐵離子。已知在一定溫度下該反應達到平衡時c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,則此溫度下該反應的平衡常數K= 。
Fe(SCN)2+ 來檢驗反應是否產生鐵離子。已知在一定溫度下該反應達到平衡時c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,則此溫度下該反應的平衡常數K= 。
(16分)Fenton法常用于處理含難降解有機物的工業廢水。通常是在調節好pH和Fe2+濃度的廢水中加入H2O2,所產生的羥基自由基能氧化降解污染物。現運用該方法降解有機污染物p-CP,試探究有關因素對該降解反應速率的影響。實驗中控制p-CP的初始濃度相同,恒定實驗溫度在298K或313K(其余實驗條件見下表)設計如下對比實驗。
(1)請完成以下實驗設計表(將表中序號處應填內容)。
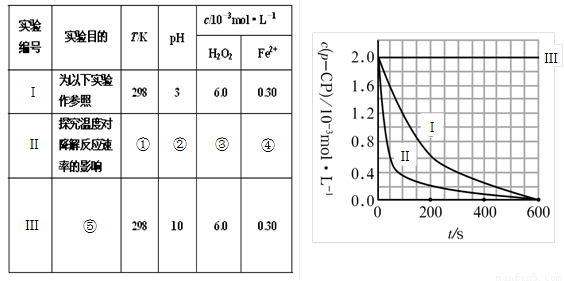
① ② ③ ④
⑤
(2)實驗測得p-CP的濃度隨時間變化的關系如右上圖所示。
a.請根據右上圖實驗Ⅰ曲線,計算降解反應在50—300s內的平均反應速率v(p-CP)= ,以及300s時p-CP的降解率為 ;
b.實驗Ⅰ、Ⅱ表明溫度升高,降解反應速率 (填“增大”、“減小”或“不變”);
c.實驗Ⅲ得出的結論是:pH=10時, ;
(3)可通過反應Fe3+
+ SCN—  Fe(SCN)2+ 來檢驗反應是否產生鐵離子。已知在一定溫度下該反應達到平衡時c(Fe3+)=0.04 mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,則此溫度下該反應的平衡常數K= 。
Fe(SCN)2+ 來檢驗反應是否產生鐵離子。已知在一定溫度下該反應達到平衡時c(Fe3+)=0.04 mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,則此溫度下該反應的平衡常數K= 。

 Fe(SCN)2+ 來檢驗反應是否產生鐵離子。已知在一定溫度下該反應達到平衡時c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,則此溫度下該反應的平衡常數K= 。
Fe(SCN)2+ 來檢驗反應是否產生鐵離子。已知在一定溫度下該反應達到平衡時c(Fe3+)="0.04" mol/L,c(SCN—)=0.1mol/L,c[Fe(SCN)2+]=0.68mol/L,則此溫度下該反應的平衡常數K= 。根據反應框圖填空,已知反應①~⑤均為工業生產及應用中常見反應,其中B、G、I、J、L均為常見單質,B、D、J、L為氣體。A是工業生產F的重要礦石原料的主要成份,其相對分子質量為120,M為海水中含量最多的無機鹽。

(1)I元素在元素周期表中的位置 ;M中陰離子的結構示意圖: 。
(2)固體A中所包含的化學鍵與固體Na2O2類似,則A的電子式為 。
(3)寫出下列化學反應的離子方程式:
① 溶液P與KSCN溶液:_____________________________________ ___;
② G與N的反應:______________________________________ __________;
③ K與L的反應:___________________________________ _____________。
(4)已知每生成16 gD,放出106.5 kJ熱量,則反應①的熱化學方程式為:
6、B 7、C 8、A 9、D 10、B 11、D 12、A 13、C
26 . ( 13 分) ( 1 ) y的電子式:  ( 2 分) 非極性( l 分)
( 2 分) 非極性( l 分)
( 2 ) 87 ( l 分)
( 3 ) C ( 1 分)
( 4 )堿( 1 分) NH3?H2O  NH4+ + OH一(2分)
NH4+ + OH一(2分)
CO32― + H2O  HCO3― + OH一( 2 分)
HCO3― + OH一( 2 分)
( 5 ) 2NH3 一 6e一+ 6OH― == N2 + 6H2O ( 2 分) 減小( 1 分)
27 . ( 16 分)

( 2 ) ① ⑥ (各 1 分,共 2 分。答 ③ 不扣分,其余有錯扣 1 分)
( 3 )羥基( l 分)羧基( 1 分)


28 . ( 16 分) ( 1 ) FeS2 ( 2 分) 沸騰爐(1分)
( 2 )氯酸鉀(或KClO3)( 1 分) 鎂條(或 Mg ) ( 1 分)

防止產生的Cl2和H2混和發生爆炸( l 分),避免Cl2和NaOH反應,使生成的 NaOH不純( 1 分)
( 4 ) 6Fe2+ +3ClO一+ 3 H2O == 2Fe(OH)3↓+3Cl―+ 4Fe3 + ( 2分)
( 5 ) I.不合理( 1 分),因為 SO2Cl2為液體,移走 SO2Cl2對反應體系中壓強和氣體濃度的影響不大(或對反應速率和 SO2Cl2的產率影響不大) ( l 分)
II.不合理( 1 分),該反應為放熱反應,升高溫度會降低 SO2Cl2的產率,但溫度過低,反應速率很小,經濟效益較低。因此,應選擇適當的溫度。( 2 分)
29.( 15 分)
( 1 )增大銅粉與氧接觸面積, 使反應迅速、充分( 2 分)
( 2 ) N2 ( 1 分),排出 D中的空氣(1分) 關閉 k3( 1 分) 打開 kl、 k2 ( 1 分)
( 3 ) 錐形瓶中玻璃管液面上升( 1 分)
( 4 )Cu 十2NO3―+ 4H + === Cu 2+ + 2NO2↑+ 2H2O ( 2 分)
( 5 ) 向下調節量氣管(或及時關閉 k3 ) ( 1分,其它合理答案也可給分)
( 6 ) I . 0.0720 mol / L ( 2 分)
II.有( 1 分) E 裝置中生成 100 mL 、0.0720 mol / L硝酸時產生的NO 約為 80.6mL, 而試管中原有 50 mL N2,二者之和小于139.00 mL ,說明生成 NO2 的同時有 NO 生成( 2 分)。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com