
題目列表(包括答案和解析)
 元素在周期表中的位置,反映了元素的原子結構和元素的性質.右圖是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子結構和元素的性質.右圖是元素周期表的一部分.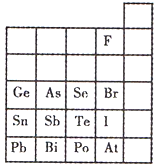 元素在周期表中的位置,反映了元素的原子結構和元素的性質.下圖是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子結構和元素的性質.下圖是元素周期表的一部分.(7分)
元素在周期表中的位置,反映了元素的原子結構和元素的性質。下圖是元素周期表的一部分。
(1)陰影部分元素N在元素周期表中的位置為 周期 族 。 根據元素周期律,預測:酸性強弱 H3AsO4 H3PO4。(用“>”或“<”表示)
(2)元素Se的最高正價和最低負價的代數和為____________; 在一定條件下,S與H2反應有一定限度(可理解為反應進行的程度),請判斷:在相同條件下Se與H2反應的限度比S與H2反應限度 。(選填“更大”、“更小”或“相同”);
(3)Br2具有較強的氧化性,SO2具有較強的還原性,將SO2氣體通入溴水后,溶液中存在的主要離子是_____________。
(4)下列說法不正確的是 。
A.C、N、O、F的原子半徑隨著原子序數的增大而減小
B.Si、P、S、Cl元素的非金屬性隨著核電荷數的增加而增強
C.干冰升華、液態水轉變為氣態都要克服分子內的共價鍵
D.HF、HCl、HBr、HI的熱穩定性依次減弱
(8分)元素在周期表中的位置,反映了元素的原子結構和元素的性質,右圖是元素周期表的一部分。
(1)陰影部分元素在元素周期表中的位置為第 族。根據元素周期律、預測;酸性強弱H2AsO4 H3PO4(用“>”或“<”表示)
(2)元素S的最高正價和最低負價的代數和為 ,在一定條件下,S與H2反應有一定限度(可理解為反應進行的程度)。請判斷:在相同條件下Se與H2反應的限度比S與H2反應限度 。(選填“更大”、“更小”或“相同”)
(3)Br2具有較強的氧化性,SO2具有較強的還原性,將SO2氣體通入溴水后,溶液中存在的主要離子是
(4)下列說法正確的是
A.C、N、O、F的原子半徑隨著原子數的增大而減小
B.Si、P、S、Cl元素的非金屬性隨著核電荷數的增加而增強
C.干冰升華、液態水轉變為氣態都要克服分子內的共價鍵
D.HF、HCl、HBr、HI的熱穩定性依次減弱
(8分)元素在周期表中的位置,反映了元素的原子結構和元素的性質,右圖是元素周期表的一部分。
(1)陰影部分元素在元素周期表中的位置為第 族。根據元素周期律、預測;酸性強弱H2AsO4 H3PO4(用“>”或“<”表示)
(2)元素S的最高正價和最低負價的代數和為 ,在一定 條件下,S與H2反應有一定限度(可理解為反應進行的程度)。請判斷:在相同條件下Se與H2反應的限度比S與H2反應限度 。(選填“更大”、“更小”或“相同”)
條件下,S與H2反應有一定限度(可理解為反應進行的程度)。請判斷:在相同條件下Se與H2反應的限度比S與H2反應限度 。(選填“更大”、“更小”或“相同”)
(3)Br2具有較強的氧化性,SO2具有較強的還原性,將SO2氣體通入溴水后,溶液中存在的主要離子是
(4)下列說法正確的是
A.C、N、O、F的原子半徑隨著原子數的增大而減小
B.Si、P、S、Cl元素的非金屬性隨著核電荷數的增加而增強
C.干冰升華、液態水轉變為氣態都要克服分子內的共價鍵
D.HF、HCl、HBr、HI的熱穩定性依次減弱
例1:D 例2:D 例3:D 例4:B 例5:A 例6:BD
例7:(1)2 4 2 2 1 2 ;H2O
(2) ② (3)0.2 (4)2.63
例8:(1)①KI+IBr=KBr+I2
②C6H6+ICl→C6H5I+HCl或 +HCl→
+HCl→ -I+HCl
-I+HCl
(2)相對分子質量越大,分子間的作用力越強
(3)介于Br2的沸點和IBr的沸點之間
例9:(1)A,B (2)非金屬;因為A+B→乙+C,且乙為單質,可知乙元素在A,B中分別呈正、負價,所以乙是非金屬。(注:答案中必須體現出“乙元素在A,B中分別呈正、負價”的含義,否則不給分。) (3)S,H2S(或:N2,NH3)
例10、(1)1 5 4 10 11 6 7 2 (10和11可顛倒)[說明:錯一個即不給分] (2)驅趕裝置中空氣,防止反應產生的NO被氧化 (3)通入O2后裝置(D)中有紅棕色氣體生成
(4)分離NO和NO2(或使NO2液化)(5)4NO2+O2+4NaOH=4NaNO3+2H2O
例11、(一)測定銅粉樣品中銅的質量分數
(三)
B、E中有氣泡產生
2H2O2 2H2O+O2↑
2H2O+O2↑
G中的紅褐色粉末變成黑色
2Cu+O2 2CuO
2CuO
C+O2 CO2
CO2
(四)
(五)偏小:水蒸汽通過G被D中堿石灰吸收;洗氣瓶 濃硫酸 (或干燥管 堿石灰)
例12、(1)減少CO和碳氫化合物的污染;光化學煙霧或破壞臭氧層
(2)溶液顯色所需要的時間
(3)A:汽車尾氣中含有一定量的CO和碳氫化合物,少消耗NH3
或B:汽車尾氣中含有一定量的NO2,多消耗NH3
或C:汽車尾氣中同時含有CO、碳氫化合物等還原性氣體和NO2等氧化性氣體,二者相對含量的不同可導致消耗NH3的增多或減少
例13、(1)將含氰化合物全部轉化為CN - (2)完全吸收HCN,防止氣體放空
(3)防止倒吸 (4)偏高 (5)109.2
例14、(1)①BaCl2、NaOH、Na2CO3(錯選或多選本小題不得分。NaOH溶液的加入順序及是否答NaOH不影響得分);②75%乙醇;(2)天平、燒杯、500mL容量瓶、膠頭滴管;(3)< 電解生成的氯氣與電解生成的NaOH發生了反應 酸堿中和滴定;(4)e d
例15、(1)a、b
(2)干燥氣體 控制氫氣和氮氣的流速
(3)不會 因為混合氣體中含有大量難溶于水的氮、氫兩種氣體
(4)說明氨的氧化反應是一個放熱反應 有紅棕色氣體產生
(5)4NH3十5O2 4NO+6H2O (6)NH4+
NO3-
4NO+6H2O (6)NH4+
NO3-
智能訓練:
1、A 2、C 3、B 4、AC 5、AB 6、D 7、C 8、B 9、B 10、A 11、B
12、A 13、B 14、D 15、C 16、A 17、D 18、A 19、C 20、C 21、C
22、C 23、D
24、(1)H2O2 + Mn2+ = MnO2 + 2H+ H2O2 +MnO2 + 2H+ = H2O + Mn2+ +O2↑
(2)5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+8H2O+5O2↑
25、(1)N2可將實驗裝置內的空氣排凈,并作為動力源將PbO與C反應生成的氣體,趕入B、C兩個實驗裝置處。不可用空氣體代替N2,空氣中的O2可與灼熱的炭反應,且空氣中還含有CO2、H2O等含氧化合物,均可導致實驗失敗。 (2) PbO+C Pb+CO↑,在裝置C處可見一氧化碳燃燒產生的淡藍色火焰。(3)可在裝置B后串聯一個內盛[Cu(NH3)2]Ac溶液的洗氣裝置,吸收一氧化碳,反應完畢,取出吸收液加熱解吸,用排水取氣法收集放出的氣體,通過進一步實驗證明該氣體是一氧化碳。 (4)可用H2代替N2和木炭,PbO+H2
Pb+CO↑,在裝置C處可見一氧化碳燃燒產生的淡藍色火焰。(3)可在裝置B后串聯一個內盛[Cu(NH3)2]Ac溶液的洗氣裝置,吸收一氧化碳,反應完畢,取出吸收液加熱解吸,用排水取氣法收集放出的氣體,通過進一步實驗證明該氣體是一氧化碳。 (4)可用H2代替N2和木炭,PbO+H2 Pb+H2O,用無水CuSO4吸收生成的水,證明氧化鉛中含有氧元素。裝置B應改用內盛CuSO4白色粉末的干燥管。
Pb+H2O,用無水CuSO4吸收生成的水,證明氧化鉛中含有氧元素。裝置B應改用內盛CuSO4白色粉末的干燥管。
26、(1)B裝置中導氣管長進短出
(2)①Cu
+ 2H2SO4(濃) CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
②反應過程中H2SO4被不斷消耗,濃硫酸逐漸變稀,至一定濃度就不再與銅片反應 ③A、D
(3)①A、B、C
②甲基橙 能,因為,在含Cu2+、H+的混合溶液中,當以甲基橙為指示劑用標準NaOH溶液進行滴定時,可以有效排除Cu2+的干擾,準確測出H+的物質的量。
27、(1)NaNO2
(2)2Cu(NO3)2
 2CuO+4NO2↑+O2↑
2CuO+4NO2↑+O2↑
石蕊試液逐漸變為紅色,液體幾乎不被壓至裝置③中
(3)Ⅱ正確,如果Ⅰ正確,則裝置②中氣泡應全部消失,不會有液體被壓至裝置③中;
向裝置①中的殘留固體加入少量濃硝酸,產生紅棕色氣體
(4)硝酸鹽受熱分解的產物與硝酸鹽中金屬的活潑性有關等
28、(1)如果是亞鐵離子干擾,不可能變紅之后,一段時間之后變成藍色
(2)
(3)2SCN-+20H++22NO3-=2SO42-+2CO2↑+N2↑+22NO2↑+10H2O
(4)比較硫氰根離子與氯離子、溴離子、碘離子的還原性強弱
(5)a、加入氧化劑如氯氣等必須少量 b、不一定
29、(1)防止因鐵粉過量而使濾渣C中合,鐵粉與H2SO4反應,生成Fe2+,干擾實驗
 (2)防止環境中O2參加反應
(3)鐵粉與硫反應是放熱的
(2)防止環境中O2參加反應
(3)鐵粉與硫反應是放熱的
(4)除去混和物中硫粉:3S+6KOH 2K2S+K2SO3+2H2O; CS2
(5)防止H2SO4溶液中溶解的氧氣把Fe2+氧化成Fe3+
(6)加熱煮沸的KSCN溶液,看是否變為血紅色
30、(1)O H Cl N
(2)NH4NO3 NH4++H2O NH3 ?H2O + H+
NH3 ?H2O + H+
(3)2NH3 NH4+ + NH2-
(4)2Na+2NH3 = 2NaNH2 +H2
NH4+ + NH2-
(4)2Na+2NH3 = 2NaNH2 +H2
 31、(1) 電子式略 F2+H2O HFO+HF
31、(1) 電子式略 F2+H2O HFO+HF
 |
 (2)HFO+H2O=HF+H2O2
(2)HFO+H2O=HF+H2O2
(3)2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
32、(1)CO2(或SO2) H2S(或H3PO4) AlCl3(或NaH2PO4)中的任意兩組
(2)S A的化合價介于B、C之間
33、(1)非金屬 因為B+C→A+X,X為不含該元素的另一化合物,且A為單質,可知A元素在B、C中分別呈正、負價,所以A是非金屬。
(2)在一定條件下,本反應用于治理NO對大氣的污染,即:4NH3+6NO=5N2+6H2O
(3)5:3 (4)NO+NO2+2OH-=2NO2- +H2O (5)a c e
34、(1)HCl (2)(CN)2+2I-=I2+2CN- (CN)2+2SCN- =2CN- +(SCN)2
(3)N顯負價,C顯正價 (4)CNO-<CN-<SCN-
35、(1)b、C (2)AgI (3)Ag、NO
36、溶液中n(H+)=
溶液中n(NO3-)=2 n(Cu2+)+n(H+)=0.350 mol
被還原的硝酸的物質的量為0.0500 L×12.0 mol?L-1-0.350 mol=0.250 mol
產生氣體的物質的量為 =0.200 mol
=0.200 mol
即n(NO)+n(NO2)+n(N2O4)=0.200 mol ①
銅失去電子的物質的量為 ×2=0.300 mol,根據電子守恒有
×2=0.300 mol,根據電子守恒有
3 n(NO)+n(NO2)+2 n(N2O4)=0.300 mol ②
根據氮元素守恒有n(NO)+n(NO2)+2 n(N2O4)=0.250 mol ③
解①、②、③得:n(NO)=0.0250 mol,n(NO2)=0.125 mol,n(N2O4)=0.0500 mol
37、(1)Fe和FeS (2) n(Fe)=0.0100mol n(FeS)=0.0150mol c(H2S)=0.0500mo/L
(3)
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com