
題目列表(包括答案和解析)
下面是甲、乙、丙3位同學制取己酸乙酯的過程,請你參與并協助他們完成相關的實驗任務。
![]() 【實驗目的】制取乙酸乙酯
【實驗目的】制取乙酸乙酯
![]() 【實驗原理】甲、乙、丙3位同學均采取乙醇、乙酸與濃硫酸混合共熱的方法制取乙酸
【實驗原理】甲、乙、丙3位同學均采取乙醇、乙酸與濃硫酸混合共熱的方法制取乙酸![]() 乙酯,其反應的化學方程式為 。
乙酯,其反應的化學方程式為 。
![]() 【裝置設計】甲、乙、丙3位同學分別設計了下列3套實驗裝置:
【裝置設計】甲、乙、丙3位同學分別設計了下列3套實驗裝置:
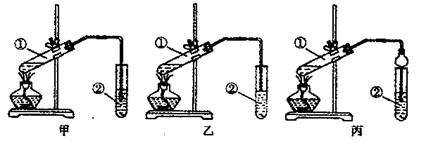
若從甲、乙同學設計的裝置中選擇一套作為實驗室制取乙酸乙酯的裝置,應選擇的裝置是 (填“甲”或“乙”)。丙同學將甲裝置中的玻璃導管改成了球形干燥管,除起冷凝作用外,另一個重要的作用是 。
![]() 【實驗步驟】a. 按所選擇的裝置組裝儀器,在試管①中先加人3 mL 95%的乙醇,并在搖動下加入2 mL濃硫酸,充分搖勻,冷卻后再加入2 mL冰醋酸;b. 將試管固定在鐵架臺上;c. 在試管②中加入5 mL飽和Na2CO3溶液;d.用酒精燈對試管①加熱心當觀察到試管②中有明顯現象時停止實驗。
【實驗步驟】a. 按所選擇的裝置組裝儀器,在試管①中先加人3 mL 95%的乙醇,并在搖動下加入2 mL濃硫酸,充分搖勻,冷卻后再加入2 mL冰醋酸;b. 將試管固定在鐵架臺上;c. 在試管②中加入5 mL飽和Na2CO3溶液;d.用酒精燈對試管①加熱心當觀察到試管②中有明顯現象時停止實驗。
![]() 【問題討論】
【問題討論】
![]() (1)步驟a中組裝好實驗裝置后,加入藥品前還應檢查 。
(1)步驟a中組裝好實驗裝置后,加入藥品前還應檢查 。
![]() (2)試管②中裝有飽和Na2CO3溶液,其作用是 (填序號)
(2)試管②中裝有飽和Na2CO3溶液,其作用是 (填序號)
![]() A.吸收乙醇
A.吸收乙醇
![]() B.除去乙酸
B.除去乙酸
![]() C.乙酸乙酯在飽和Na2CO3溶液中的溶解度更小,有利于分層析出
C.乙酸乙酯在飽和Na2CO3溶液中的溶解度更小,有利于分層析出
![]() D.加速酯的生成,提高其產率
D.加速酯的生成,提高其產率
![]() (3)根據試營②中觀察到的現象,可知乙酸乙酯的物理性質有 。
(3)根據試營②中觀察到的現象,可知乙酸乙酯的物理性質有 。
(12分)復分解反應是中學化學中常見的一種反應類型。
(1)已知在常溫下測得濃度均為0.1mol/L的下列6種溶液的pH值:
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
復分解存在這樣一個規律:一種較強酸與另一種較弱酸的鹽可以自發地反應,生成較弱酸和較強酸的鹽,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若換個角度看,它同時揭示出另一條規律,即堿性較強的物質發生類似反應可以生成堿性較弱的物質。依照該規律,請判斷下列反應不能成立的是______(填編號)。
A、CO2+H2O+2NaClO===Na2CO3+2HClO
B、CO2+H2O+NaClO===NaHCO3+HClO
C、CO2 +H2O+C6H5ONa![]() NaHCO3+C6H5OH
NaHCO3+C6H5OH
D、CO2 +H2O+2C6H5ONa![]() Na2CO3+2C6H5OH
Na2CO3+2C6H5OH
E、Na2CO3+C6H5OH![]() NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F、CH3COOH+NaCN===CH3COONa+HCN
(2)根據前述信息判斷,濃度均為0.05mol/L的下列六種物質的溶液中,pH最小的是______(填編號); pH最大的是_________(填編號)。
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)一些復分解反應的發生還遵循其它的規律。下列轉化都屬于復分解反應:
①蒸發KCl和NaNO3混合溶液,首先析出NaCl晶體
②侯氏制堿法中,向飽和食鹽水先通入足量氨氣,再通入二氧化碳,可獲得小蘇打晶體
根據上述反應,總結出復分解反應發生的另一規律:______________;
將KI溶液和AgCl固體混合攪拌,會觀察到的現象是_______________,請寫出反應的離子方程式: __________。


名稱 | 化學式 | 顏色、狀態 | 溶解度(g) | 熔點(℃) | 密度(g/cm3) |
乙二酸 | H | — | 8.6(20℃) | 189.5 | 1.900 |
二水合乙二酸 | H | 無色晶體 | — | 101.5 | 1.650 |
注:乙二酸(HOOC—COOH)俗稱草酸,帶2個結晶水的乙二酸俗稱草酸晶體,草酸晶體失去結晶水得無水草酸,在約157℃時升華,其鹽草酸鈣和草酸氫鈣均為白色不溶物。根據上述信息,回答下列問題。
(1)向盛有Na2CO3粉末的試管里加入約3 mL乙二酸溶液,觀察到的現象是________________。
(2)向盛有5 mL乙二酸飽和溶液的試管里滴入3滴用硫酸酸化的0.5%(質量分數)的高錳酸鉀溶液,振蕩,觀察到的現象為____________,說明乙二酸有_____________性。
(3)已知草酸分解的化學方程式為:H![]() H2O+CO2↑+CO↑,用如圖裝置加熱草酸晶體,驗證草酸受熱分解及其產物,但有人認為該裝置不合理。請你根據草酸晶體的某些物理常數和實驗目的,分析不合理原因_____________(從下列序號中選擇)。
H2O+CO2↑+CO↑,用如圖裝置加熱草酸晶體,驗證草酸受熱分解及其產物,但有人認為該裝置不合理。請你根據草酸晶體的某些物理常數和實驗目的,分析不合理原因_____________(從下列序號中選擇)。
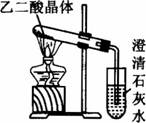
a.草酸晶體的熔點低,未分解之前就已融化并流到試管口,不利于化學反應的進行及實驗現象的觀察
b.因為加熱的是草酸晶體,所以該裝置最多只能檢驗一種分解產物,不能檢驗是否還有其他分解產物
C.在未洗氣的情況下通入石灰水,還可能因草酸蒸氣與石灰水反應生成草酸鈣沉淀,對實驗有干擾
(4)設裝置也不符合綠色化學的要求,試說明原因____________________________。
(5)實驗室用酸堿滴定法測定草酸晶體分子中結晶水個數的方法如下:稱取a g草酸晶體溶于水配成200 mL溶液,取20 mL該溶液用0.1 mol·L-1NaOH溶液滴定,當達到終點時,用去NaOH溶液b mL,則每個草酸晶體分子中結晶水個數x=__________(用字母表示算式)。
鎂、鋁、鐵及其化合物在生產、生活中有著廣泛的應用
I:實驗室采用MgCl2、AlCl3的混合溶液與過量氨水反應制備MgAl2O4,主要流程如下: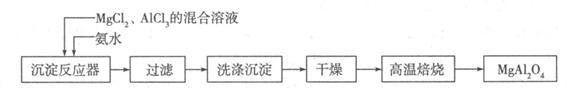
(1)已知25℃時Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34,該溫度下向濃度均為0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成 沉淀(填化學式)。
(2)高溫焙燒時發生反應的化學方程式 ,洗滌沉淀時的方法是 。
(3)常溫下如果向AlCl3飽和溶液中不斷通人HCl氣體,可析出AlCl3·6H2O晶體,結合化學平衡移動原理解釋析出晶體的原因: 。
Ⅱ:某興趣小組的同學發現將一定量的鐵與濃硫酸加熱時,觀察到鐵完全溶解,并產生大量氣體。為此,他們設計了如下裝置驗證所產生的氣體。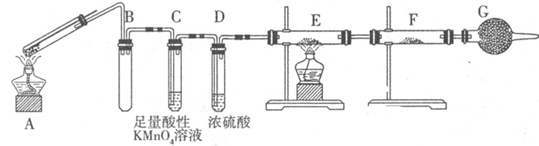
(1)G裝置的作用是 。
(2)證明有SO2生成的現象是 ,為了證明氣體中含有氫氣,裝置E和F中加入的試劑分別為 、 。
(3)若將鐵絲換成銅絲,反應后的溶液沒有出現預計的藍色溶液,而出現了大量白色固體,原因是 。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com