
題目列表(包括答案和解析)
(1)環境專家認為可以用金屬鋁將水體中的NO![]() 轉化為N2,從而清除污染。該反應中涉及的粒子有:H2O、Al、OH
轉化為N2,從而清除污染。該反應中涉及的粒子有:H2O、Al、OH![]() 、Al(OH)3、NO
、Al(OH)3、NO![]() 、N2,請將各粒子分別填入以下空格內(不用配平)。
、N2,請將各粒子分別填入以下空格內(不用配平)。
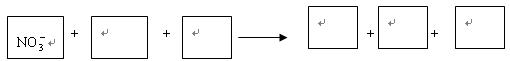
該反應過程中,被氧化與被還原的元素的物質的量之比為 。
(2)我國首創的海洋電池以海水為電解質溶液,電池總反應為:4Al+3O2+6H2O=
4Al(OH)3。電池正極的電極反應式為 ;正極材料采用了鉑網,利用鉑網為正極的優點是 。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+![]() C(s)=
C(s)= ![]() CO2(g)+2Fe(s) △H=234.1kJ/mol
CO2(g)+2Fe(s) △H=234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
寫出鋁與氧化鐵發生鋁熱反應的熱化學方程式 。
(4)將一定質量的鈉鋁合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L鹽酸滴定,可得沉淀質量與消耗的鹽酸體積關系如下圖:
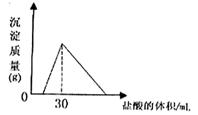
則反應過程中產生氫氣的總體積為 L(標準狀況)。
(12分)(1)環境專家認為可以用金屬鋁將水體中的NO![]() 轉化為N2,從而清除污染。該反應中涉及的粒子有:H2O、Al、OH
轉化為N2,從而清除污染。該反應中涉及的粒子有:H2O、Al、OH![]() 、Al(OH)3、NO
、Al(OH)3、NO![]() 、N2,請將各粒子分別填入以下空格內(不用配平)。
、N2,請將各粒子分別填入以下空格內(不用配平)。
該反應過程中,被氧化與被還原的元素的物質的量之比為 。
(2)我國首創的海洋電池以海水為電解質溶液,電池總反應為:4Al+3O2+6H2O=
4Al(OH)3。電池正極的電極反應式為 ;正極材料采用了鉑網,利用鉑網為正極的優點是 。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+![]() C(s)=
C(s)=![]() CO2(g)+2Fe(s) △H=234.1kJ/mol
CO2(g)+2Fe(s) △H=234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
寫出鋁與氧化鐵發生鋁熱反應的熱化學方程式 。
(4)將一定質量的鈉鋁合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L鹽酸滴定,可得沉淀質量與消耗的鹽酸體積關系如下圖:
則反應過程中產生氫氣的總體積為 L(標準狀況)。
(4分)(1)同素異形體相互轉化的反應熱相當小而且轉化速率很慢,有時還很不完全,測定反應熱有時很困難,因此常用蓋斯定律進行計算得到相應數據。已知:
P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1
P(紅磷,s)+![]() O2(g)=
O2(g)=![]() P4O10(s) △H=-738.5kJ·mol-1
P4O10(s) △H=-738.5kJ·mol-1
則白磷轉化為紅磷的熱化學方程式為____________________。
(2)已知:① C(s)+O2(g)=CO2(g); DH=—393.5kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
則TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
(12分)(1)環境專家認為可以用金屬鋁將水體中的NO 轉化為N2,從而清除污染。該反應中涉及的粒子有:H2O、Al、OH
轉化為N2,從而清除污染。該反應中涉及的粒子有:H2O、Al、OH 、Al(OH)3、NO
、Al(OH)3、NO 、N2,請將各粒子分別填入以下空格內(不用配平)。
、N2,請將各粒子分別填入以下空格內(不用配平)。
該反應過程中,被氧化與被還原的元素的物質的量之比為 。
(2)我國首創的海洋電池以海水為電解質溶液,電池總反應為:4Al+3O2+6H2O=
4Al(OH)3。電池正極的電極反應式為 ;正極材料采用了鉑網,利用鉑網為正極的優點是 。
(3)已知:4Al(s)+3O2(g)=2Al2O3(g) △H=-2834.9kJ/mol
Fe2O3(s)+ C(s)=
C(s)=  CO2(g)+2Fe(s) △H=234.1kJ/mol
CO2(g)+2Fe(s) △H=234.1kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
寫出鋁與氧化鐵發生鋁熱反應的熱化學方程式 。
(4)將一定質量的鈉鋁合金置于水中,合金全部溶解,得到20mol,pH=14的溶液,然后2mol/L鹽酸滴定,可得沉淀質量與消耗的鹽酸體積關系如下圖:
則反應過程中產生氫氣的總體積為 L(標準狀況)。
(4分)(1)同素異形體相互轉化的反應熱相當小而且轉化速率很慢,有時還很不完全,測定反應熱有時很困難,因此常用蓋斯定律進行計算得到相應數據。已知:
P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1
P(紅磷,s)+ O2(g)=
O2(g)=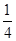 P4O10(s) △H=-738.5kJ·mol-1
P4O10(s) △H=-738.5kJ·mol-1
則白磷轉化為紅磷的熱化學方程式為____________________。
(2)已知:① C(s)+O2(g)=CO2(g); DH=—393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
則TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com