
題目列表(包括答案和解析)
下列關于熱化學反應的描述中正確的是 ( )
A.500℃、30MPa下,將0.5mol N2和1.5molH2置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,其熱化學方程式為:N2(g) + 3H2(g)2NH3(g) △H=-38.6kJ·mol-1
B.HCl和NaOH反應的中和熱ΔH=-57.3 kJ·mol-1,則H2SO4和Ca(OH)2反應的中和熱ΔH=2×(-57.3)kJ·mol-1
C.CO(g)的燃燒熱是283.0 kJ·mol-1,則2CO2(g) =2CO(g)+O2(g)反應的 ΔH=+2×283.0 kJ·mol-1
D.1 mol甲烷燃燒生成氣態水和二氧化碳所放出的熱量是甲烷燃燒熱
下列關于熱化學反應的描述中正確的是( )
A.HCl和NaOH反應的中和熱△H=-57.3kJ/mol,則H2SO4和Ca(OH)2反應的中和熱
△H=2×(-57.3)kJ/mol
B.CO(g)的燃燒熱是283.0kJ/mol,則2CO2(g)=2CO(g)+O2(g)反應的△H=+2×283.0kJ/mol
C.△H>0,△S>0,在任何溫度下都不可自發進行。
D.1mol甲烷燃燒生成氣態水和二氧化碳所放出的熱量是甲烷的燃燒熱
下列關于熱化學反應的描述中正確的是 ( )
A.500℃、30MPa下,將0.5mol N2和1.5molH2置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,其熱化學方程式為:N2(g) + 3H2(g)2NH3(g) △H=-38.6kJ·mol-1
B.HCl和NaOH反應的中和熱ΔH=-57.3 kJ·mol-1,則H2SO4和Ca(OH)2反應的中和熱ΔH=2×(-57.3)kJ·mol-1
C.CO(g)的燃燒熱是283.0 kJ·mol-1,則2CO2(g) =2CO(g)+O2(g)反應的 ΔH=+2×283.0 kJ·mol-1
D.1 mol甲烷燃燒生成氣態水和二氧化碳所放出的熱量是甲烷燃燒熱
下列關于熱化學反應的描述中正確的是( )
| A.HCl和NaOH反應的中和熱△H=-57.3kJ/mol,則H2SO4和Ca(OH)2反應的中和熱為2×(-57.3)kJ/mol |
| B.CO(g)的燃燒熱是283.0 kJ/mol,則表示CO燃燒熱的熱化學方程式為 CO(g)+1/2 O2(g) ===CO2 (g)△H=-283.0 kJ/mol |
| C.需要加熱才能發生的反應一定是吸熱反應 |
| D.等物質的量的硫蒸氣和硫固體分別完全燃燒,后者放出熱量多 |
下列關于熱化學反應的描述中正確的是( )
A.500℃、30MPa下,將0.5mol N2和1.5molH2置于密閉的容器中充分反應生成NH3(g),放熱19.3kJ,其熱化學方程式為:N2(g) + 3H2(g) 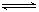 2NH3(g) △H=-38.6kJ·mol-1 2NH3(g) △H=-38.6kJ·mol-1 |
| B.HCl和NaOH反應的中和熱ΔH=-57.3 kJ·mol-1,則H2SO4和Ca(OH)2反應的中和熱ΔH=2×(-57.3)kJ·mol-1 |
| C.CO(g)的燃燒熱是283.0 kJ·mol-1,則2CO2(g) =2CO(g)+O2(g)反應的ΔH=+2×283.0 kJ·mol-1 |
| D.1 mol甲烷燃燒生成氣態水和二氧化碳所放出的熱量是甲烷的燃燒熱 |
選擇題答案(18×3=54分)
題號
1
2
3
4
5
6
7
8
9
答案
C
A
C
C
D
B
B
C
A
題號
10
11
12
13
14
15
16
17
18
答案
D
C
B
B
D
D
A
D
B
二、填空題
19(6分).(1)12 (2)6 (3)2
20 (8分)(1)碳碳雙鍵、醛基
(2)OHCCH.files/image010.gif) CHO+4Ag(NH
CHO+4Ag(NH.files/image018.gif) )
).files/image010.gif) OH
OH.files/image021.gif) 4Ag+NH
4Ag+NH.files/image023.gif) OOCCH
OOCCH.files/image010.gif) COONH
COONH.files/image023.gif) +6NH3+2H
+6NH3+2H.files/image010.gif) O
O
.files/image027.jpg) (3)HOCH
(3)HOCH.files/image010.gif) CH
CH.files/image010.gif) CH
CH.files/image010.gif) OH+HOOCCH
OH+HOOCCH.files/image010.gif) COOH
COOH
酯化反應(取代反應)
21(12分):(1)自來水含有電解質,會使膠體聚沉
(2)濃度太小不利于生成膠體
(3)加熱會使膠體聚沉
(4)丁達爾效應,滲析,在滲析液中加入AgNO3溶液,若無明顯現象則證明完全分離。
三、實驗題:
22(11分)(1)坩堝鉗、酒精燈(可以不答“火柴”)
(2)步驟②有錯誤 應先將試樣研細,后放入坩堝稱重
(3)因硫酸鈉放置在空氣中冷卻時,會吸空氣中的水分
(4)保證試樣脫水完全
(5)B、D、F
.files/image032.jpg) 四、計算題(9分)
四、計算題(9分)
23.(9分)分子式C6H6O(5分) 結構簡式 (4)
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com