
題目列表(包括答案和解析)
(14分)研究CO2與CH4的反應使之轉化為CO和H2,對減緩燃料危機,減少溫室效應具有重要的意義。
(1)已知:①2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-484kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-802kJ·mol-1
則CH4(g)+CO2(g)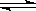 2CO(g)+2H2(g) △H= kJ·mol-1
2CO(g)+2H2(g) △H= kJ·mol-1
(2)在密閉容器中通入物質的量濃度均為0.1mol·L-1的CH4與CO2,在一定條件下發生反應CH4(g)+CO2(g)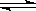 2CO(g)+2H2(g),測得CH4的平衡轉化率與溫度、壓強的關系如下圖所示。
2CO(g)+2H2(g),測得CH4的平衡轉化率與溫度、壓強的關系如下圖所示。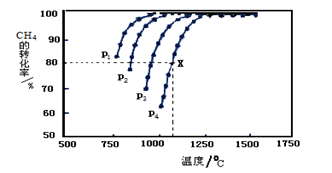
?據圖可知,P1、P2、 P3、P4由大到小的順序 。
?在壓強為P4、1100℃的條件下,該反應5min時達到平衡點X,則用CO表示該反應的速率為 。該溫度下,反應的平衡常數為 。
(3)CO和H2在工業上還可以通過反應C(s)+H2O(g) 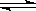 CO(g)+H2 (g)來制取。
CO(g)+H2 (g)來制取。
①在恒溫恒容下,如果從反應物出發建立平衡,可認定平衡已達到的是
| A.體系壓強不再變化 | B.H2與CO的物質的量之比為1 :1 |
| C.混合氣體的密度保持不變 | D.氣體平均相對分子質量為15,且保持不變 |
 2CO(g)+2H2(g) △H= kJ·mol-1
2CO(g)+2H2(g) △H= kJ·mol-1 2CO(g)+2H2(g),測得CH4的平衡轉化率與溫度、壓強的關系如下圖所示。
2CO(g)+2H2(g),測得CH4的平衡轉化率與溫度、壓強的關系如下圖所示。
 CO(g)+H2 (g)來制取。
CO(g)+H2 (g)來制取。| A.體系壓強不再變化 | B.H2與CO的物質的量之比為1 :1 |
| C.混合氣體的密度保持不變 | D.氣體平均相對分子質量為15,且保持不變 |

(12分)(1)從能量的變化和反應的快慢等角度研究反應:2H2 + O2 = H2O。 已知該反應為放熱反應,下圖能正確表示該反應中能量變化的是________。
從斷鍵和成鍵的角度分析上述反應中能量的變化。化學鍵的鍵能如下表:
| 化學鍵 | H—H | O=O | H—O |
| 鍵能kJ/mol | 436 | 496 | 463 |
 xC(g),反應1min時測得剩余1.8molA,C的濃度為0.4mol/L,則1min內,B的平均反應速率為 ;X為 。若反應經2min達到平衡,平衡時C的濃度 0.8mol/L(填“大于,小于或等于”)。若已知達平衡時,該容器內混合氣體總壓強為p,混合氣體起始壓強為p0。請用p0、p來表示達平衡時反應物A的轉化率為 。
xC(g),反應1min時測得剩余1.8molA,C的濃度為0.4mol/L,則1min內,B的平均反應速率為 ;X為 。若反應經2min達到平衡,平衡時C的濃度 0.8mol/L(填“大于,小于或等于”)。若已知達平衡時,該容器內混合氣體總壓強為p,混合氣體起始壓強為p0。請用p0、p來表示達平衡時反應物A的轉化率為 。 2CO(g)+2H2(g) △H= kJ·mol-1
2CO(g)+2H2(g) △H= kJ·mol-1 2CO(g)+2H2(g),測得CH4的平衡轉化率與溫度、壓強的關系如下圖所示。
2CO(g)+2H2(g),測得CH4的平衡轉化率與溫度、壓強的關系如下圖所示。
 CO(g)+H2 (g)來制取。
CO(g)+H2 (g)來制取。| A.體系壓強不再變化 | B.H2與CO的物質的量之比為1:1 |
| C.混合氣體的密度保持不變 | D.氣體平均相對分子質量為15,且保持不變 |

向2L密閉容器中通入amol 氣體A和bmol氣體B,在一定條件下發生反應:xA(g)+yB(g) ![]() pC(g)+qD(g)。
pC(g)+qD(g)。
已知:平均反應速率vC=1/2vA;反應2min 時,A的濃度減少了1/3,B的物質的量減少了a/2mol,有a mol D生成。
回答下列問題:
(1)化學方程式中,x= 、y= 、p= 、q= ;
(2)反應2min內,vA = ;
(3)反應平衡時,D為 2amol,則B的轉化率為 ;
(4)已知該反應在不同溫度下的平衡常數如下:
| 溫度℃ | 1000 | 1150 | 1300 |
| 平衡常數 | 4.0 | 3.7 | 3.5 |
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com