
題目列表(包括答案和解析)
問題1:設(shè)空氣中N2、O2的含量分別為0.80和0.20(體積分?jǐn)?shù)),則110 L空氣和足量的FeS2完全反應(yīng)后,氣體體積(同溫同壓)變?yōu)?U> L。
問題2:為了防止環(huán)境污染并對尾氣進(jìn)行綜合利用,硫酸廠常用氨水吸收尾氣中的SO2、SO3等氣體,再向吸收液中加入濃硫酸,以制取高濃度的SO2及(NH4)2SO4和NH4HSO4固體。
為了測定上述(NH4)2SO4和NH4HSO4固體混合物的組成,現(xiàn)稱取該樣品四份,分別加入相同濃度的NaOH溶液50.00 mL,加熱至120 ℃左右,使氨氣全部逸出〔(NH4)2SO4和NH4HSO4的分解溫度均高于200 ℃〕,測得有關(guān)實(shí)驗(yàn)數(shù)據(jù)如下(標(biāo)準(zhǔn)狀況):
實(shí)驗(yàn)序號 | 樣品的質(zhì)量/g | NaOH溶液的體積/mL | 氨氣的體積/L |
1 | 3.62 | 50.00 | 0.896 |
2 | 7.24 | 50.00 | 1.792 |
3 | 10.86 | 50.00 | 2.016 |
4 | 14.48 | 50.00 | 1.568 |
(1)由1組數(shù)據(jù)直接推測:用1.81 g樣品進(jìn)行同樣實(shí)驗(yàn)時(shí),生成氨氣的體積(標(biāo)準(zhǔn)狀況)為 L。
(2)試計(jì)算該混合物中(NH4)2SO4和NH4HSO4的物質(zhì)的量之比為 。
(3)求所用NaOH溶液的物質(zhì)的量濃度。(寫出計(jì)算過程)
實(shí)驗(yàn) | 序號樣品的質(zhì)量/g | NaOH溶液的體積/mL | 氨氣的體積/L |
1 | 3.62 | 50.00 | 0.896 |
2 | 7.24 | 50.00 | 1.792 |
3 | 10.86 | 50.00 | 2.016 |
4 | 14.48 | 50.00 | 1.568 |
(1)由1組數(shù)據(jù)直接推測,1.81 g樣品進(jìn)行同樣實(shí)驗(yàn)時(shí),生成氨氣的體積(標(biāo)況)為________ L。
(2)試計(jì)算該混合物中(NH4)2SO4和NH4HSO4的物質(zhì)的量之比為___________。
(3)求所有NaOH溶液的物質(zhì)的量濃度為___________ mol·L-1。
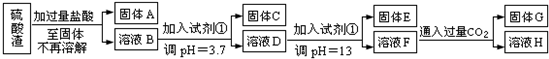
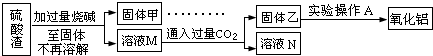
硫酸是極其重要的化工原料,在工業(yè)、農(nóng)業(yè)、醫(yī)藥、軍事等領(lǐng)域應(yīng)用廣泛。工業(yè)上通常用接觸法制硫酸,主要原料是硫鐵礦和空氣。接觸法制硫酸的生產(chǎn)過程大致可分為三個(gè)階段:①二氧化硫的制取和凈化;②二氧化硫轉(zhuǎn)化為三氧化硫;③三氧化硫的吸收和硫酸的生成。
問題1:設(shè)空氣中N2、O2的含量分別為0.80和0.20(體積分?jǐn)?shù)),則110 L空氣和足量的FeS2完全反應(yīng)后,氣體體積(同溫同壓)變?yōu)長。
問題2:為了防止環(huán)境污染并對尾氣進(jìn)行綜合利用,硫酸廠常用氨水吸收尾氣中的SO2、SO3等氣體,再向吸收液中加入濃硫酸,以制取高濃度的SO2及(NH4)2SO4和NH4HSO4固體。
為了測定上述(NH4)2SO4和NH4HSO4固體混合物的組成,現(xiàn)稱取該樣品四份,分別加入相同濃度的NaOH溶液50.00 mL,加熱至120 ℃左右,使氨氣全部逸出〔(NH4)2SO4和NH4HSO4的分解溫度均高于200 ℃〕,測得有關(guān)實(shí)驗(yàn)數(shù)據(jù)如下(標(biāo)準(zhǔn)狀況):
| 實(shí)驗(yàn)序號 | 樣品的質(zhì)量/g | NaOH溶液的體積/mL | 氨氣的體積/L |
| 1 | 3.62 | 50.00 | 0.896 |
| 2 | 7.24 | 50.00 | 1.792 |
| 3 | 10.86 | 50.00 | 2.016 |
| 4 | 14.48 | 50.00 | 1.568 |
(1)由1組數(shù)據(jù)直接推測:用1.81 g樣品進(jìn)行同樣實(shí)驗(yàn)時(shí),生成氨氣的體積(標(biāo)準(zhǔn)狀況)為 L。
(2)試計(jì)算該混合物中(NH4)2SO4和NH4HSO4的物質(zhì)的量之比為 。
(3)求所用NaOH溶液的物質(zhì)的量濃度。(寫出計(jì)算過程)


湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺 | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com