
題目列表(包括答案和解析)
研究物質的性質時,首先要分離提純物質,對物質進行分離提純是化學實驗的重要內容.
Ⅰ.現需要純凈的氯化鈉溶液,但實驗室中只有混有硫酸鈉、碳酸氫銨的氯化鈉固體.某同學設計了一個除去雜質獲得純凈氯化鈉溶液的實驗方案:
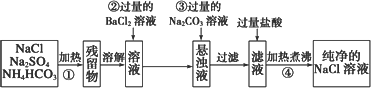
(1)操作①中發生反應的化學方程式是________.
(2)操作②中BaCl2溶液能否改用硝酸鋇溶液________(填“能”或“不能”).如果能,下一空不需要回答;如果不能,請說明理由:________.
(3)操作③的目的是________.
(4)操作④的目的是________.
Ⅱ.為提純某Fe2O3樣品(主要雜質有SiO2、Al2O3),參照上述實驗操作,請設計一種以框圖形式表示的實驗方案(注明物質和操作).

弱電解質的電離平衡、鹽類的水解平衡和難溶物的溶液平衡均屬于化學平衡.
Ⅰ、已知H2A在水中存在以下平衡:H2A![]() H++HA-,HA-
H++HA-,HA-![]() H++A2-.
H++A2-.
(1)NaHA溶液的pH________(填大于、小于或等于)Na2A溶液的pH.
(2)某溫度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性.此時該混合溶液中下列關系中,一定正確的是________.
a.c(H+)·c(OH-)=1×10-14
b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+)
d.c(Na+)+c(K+)=0.05 mol/L
(3)已知常溫下H2A的鈣鹽(CaA)飽和溶液中存在以下平衡:
CaA(s)![]() Ca2+(aq)+A2-(aq) ΔH>0.
Ca2+(aq)+A2-(aq) ΔH>0.
①降低溫度時,Ksp________(填“增大”、“減小”或“不變”).
②滴加少量濃鹽酸,c(Ca2+)________(填“增大”、“減小”或“不變”).
Ⅱ、含有Cr2O72-的廢水毒性較大,某工廠廢水中含5.00×10-3 mol·L-1的Cr2O72-.為使廢水能達標排放,作如下處理:
Cr2O72-![]() Cr3+、Fe3+
Cr3+、Fe3+![]() Cr(OH)3、Fe(OH)3
Cr(OH)3、Fe(OH)3
(1)該廢水中加入綠礬和H+,發生反應的離子方程式為:________.
(2)欲使10L該廢水中的Cr2O72-完全轉化為Cr3+,理論上需要加入________g FeSO4·7H2O.
(3)若處理后的廢水中殘留的c(Fe3+)=2×10-13mol·L-1,則殘留的Cr3+的濃度為________.(已知:Ksp[Fe(OH)3]=4.0×10-38 Ksp[Cr(OH)3]=6.0×10-31)
(12分)弱電解質的電離平衡、鹽類的水解平衡和難溶物的溶液平衡均屬于化學平衡。
I、已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。
H++A2-。
⑴NaHA溶液的pH (填大于、小于或等于) Na2A溶液的pH。
⑵某溫度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性。此時該混合溶液中下列關系中,一定正確的是 。
a.c(H+)·c(OH-)=1×10―14 b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05 mol/L
⑶已知常溫下H2A的鈣鹽(CaA)飽和溶液中存在以下平衡:
CaA(s) Ca2+(aq)+A2-(aq) △H>0。
Ca2+(aq)+A2-(aq) △H>0。
①降低溫度時,Ksp (填“增大”、“減小”或“不變”)。
②滴加少量濃鹽酸,c(Ca2+) (填“增大”、“減小”或“不變”)。
II、含有Cr2O72-的廢水毒性較大,某工廠廢水中含5.00×10-3 mol·L-1的Cr2O72-。為使廢水能達標排放,作如下處理:
(1)該廢水中加入綠礬(FeSO4·7H2O)和H+,發生反應的離子方程式為: 。
(2)欲使10L該廢水中的Cr2O72-完全轉化為Cr3+,理論上需要加入 g FeSO4·7H2O。
(3)若處理后的廢水中殘留的c(Fe3+)=2×10-13mol·L-1,則殘留的Cr3+的濃度為 。(已知:Ksp[Fe(OH)3]=4.0×10-38 Ksp[Cr(OH)3]=6.0×10-31)
(12分)弱電解質的電離平衡、鹽類的水解平衡和難溶物的溶液平衡均屬于化學平衡。
I、已知H2A在水中存在以下平衡:H2A H++HA-,HA-
H++HA-,HA- H++A2-。
H++A2-。
⑴NaHA溶液的pH (填大于、小于或等于) Na2A溶液的pH。
⑵某溫度下,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1 mol/L KOH溶液至溶液呈中性。此時該混合溶液中下列關系中,一定正確的是 。
a.c(H+)·c(OH-)=1×10―14 b.c(Na+)+c(K+)=c(HA-)+2c(A2-)
c.c(Na+)>c(K+) d.c(Na+)+c(K+)=0.05 mol/L
⑶已知常溫下H2A的鈣鹽(CaA)飽和溶液中存在以下平衡:
CaA(s) Ca2+(aq)+A2-(aq)
△H>0。
Ca2+(aq)+A2-(aq)
△H>0。
①降低溫度時,Ksp (填“增大”、“減小”或“不變”)。
②滴加少量濃鹽酸,c(Ca2+) (填“增大”、“減小”或“不變”)。
II、含有Cr2O72-的廢水毒性較大,某工廠廢水中含5.00×10-3 mol·L-1的Cr2O72-。為使廢水能達標排放,作如下處理:

(1)該廢水中加入綠礬(FeSO4·7H2O)和H+,發生反應的離子方程式為: 。
(2)欲使10L該廢水中的Cr2O72-完全轉化為Cr3+,理論上需要加入 g FeSO4·7H2O。
(3)若處理后的廢水中殘留的c(Fe3+)=2×10-13mol·L-1,則殘留的Cr3+的濃度為 。(已知:Ksp[Fe(OH)3]=4.0×10-38 Ksp[Cr(OH)3]=6.0×10-31)
下表列出了幾種物質的物理性質數據,請參考相關物質的數據合成1-溴丁烷。實驗室制備1—溴丁烷的反應如下:①NaBr + H2SO4 ?= HBr + NaHSO4 ;②R—OH + HBr ![]() R—Br +H2O可能存在的副反應有:加熱過程中反應混合物會呈現黃色或紅棕色;醇在濃硫酸存在下脫水生成烯和醚等。請回答下列問題:
R—Br +H2O可能存在的副反應有:加熱過程中反應混合物會呈現黃色或紅棕色;醇在濃硫酸存在下脫水生成烯和醚等。請回答下列問題:
正丁醇 | 1-溴丁烷 | 正丁醚 | |
熔點/℃ | -89.53 | -112.4 | -98 |
沸點/℃ | 117.7 | 101.6 | 142 |
密度/g.cm-3 | 0.8098 | 1.2758 | 0.769 |
水溶性 | 微溶 | 不溶 | 不溶 |
實驗一:實驗室制取少量1-溴丁烷的裝置如圖所示。在a中,加入7.0ml正丁醇、足量的溴化鈉和1:1的硫酸。
(1)寫出裝置圖中玻璃儀器的名稱:a ▲ ,b ▲ 。
(2)配制體積比1:1的硫酸所用的定量儀器為 ▲ (填字母)。
A.天平 B.量筒 C.容量瓶
(3)制備操作中,加入的濃硫酸必須進行適當的稀釋,其目的是 ▲ (填字母)。
A.減少副產物烯和醚的生成 B.減少Br2的生成
C.減少HBr的揮發 D.水是反應的催化劑

實驗二:先利用圖甲裝置把制備得到的粗產品水洗,水洗時需加入碳酸鈉固體加以提純;再利用圖乙裝置進行蒸餾提純。
|
|

(4)用圖甲裝置進行水洗提純時,往往要加入Na2CO3固體,其作用主要是除去 ▲ 。在圖乙裝置中加入適當的干燥劑,并將洗滌后的粗產品通過分液漏斗轉移到圖乙裝置中進行蒸餾。下列可做為粗產品蒸餾提純時的干燥劑的是 ▲ 。(填字母)
A.NaOH固體 B.堿石灰 C.無水硫酸鈉 D.無水氯化鈣
(5)用圖乙裝置進行蒸餾提純時,當溫度計顯示 ▲ 時,收集1-溴丁烷。
(6)若獲得了1-溴丁烷為7.0克,試計算其產率 ▲ 。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com