
題目列表(包括答案和解析)
過氧化氫在催化劑作用下可快速產生氧氣,它不僅是常用的消毒劑,還在航天和軍事工業上有重要的用途。
(1)寫出在過氧化氫溶液中加入MnO2粉末時,反應的化學方程式 。
(2)常用的消毒劑CH3COOOH(過氧乙酸),可以用冰醋酸和過氧化氫反應制取。制取時的化學反應方程式為 。該消毒劑中含有的少量過氧化氫,可以用它與高錳酸鉀、次氯酸鈉等強氧化劑的反應進行測定。請問,該消毒劑能否與漂粉精混合使用。
(3)過氧化氫和強還原劑液態肼(N2H4)可構成火箭推進劑。當它們混合反應時,即產生大量氮氣和水蒸氣,并放出大量熱。已知0.4 rnol液態肼與足量的過氧化氫反應,生成氮氣和水蒸氣,放出236.64kJ的熱量。
①寫出該反應的熱化學方程式 。
②又知H2O(l)=H2O(g);![]() 44 kJ?mol
44 kJ?mol![]() ,則16 g液態肼與過氧化氫反應生成液態水時放出的熱量是 kJ。
,則16 g液態肼與過氧化氫反應生成液態水時放出的熱量是 kJ。
③此反應用于火箭推進,除釋放大量熱和快速產生大量氣體外,還有―個很大的優點是
| 光 |
| ||
| ||

| ||
| ||
一定條件下,在體積為3L的密閉容器中,一氧化碳與氫氣反應生成甲醇(催化劑為Cu2O/ZnO):CO(g)+ 2H2(g) CH3OH(g)
CH3OH(g)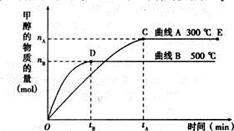
根據題意完成下列各題:
(1)5000C,從反應開始到平衡,甲醇的平均反應速率v(CH3OH)= (用nB、 tB 表示)
(2)在其他條件不變的情況下,將處于E點的體系的體積壓縮到原來的1/2,下列有關該體系的說法正確的是
a .氫氣的濃度減少 b.正反應速率加快,逆反應速率也加快
c.甲醇的物質的量增加 d.重新平衡時n(H2)/n(CH3OH)增大
(3)可逆反應:CO(g)+ 2H2(g) CH3OH(g) 在恒容密閉容器中反應,達到平衡狀態的標志是:
CH3OH(g) 在恒容密閉容器中反應,達到平衡狀態的標志是:
①單位時間內生成2n molH2的同時生成n mol CH3OH
②單位時間內生成2n molH2的同時,生成n mol CO
③用CO、H2、CH3OH 的物質的量濃度變化表示的反應速率的比為1 : 2 : 1的狀態
④混 合氣體的密度不再改變的狀態
⑤ 混合氣體的平均相對分子質量不再改變的狀態
(4)改變下列哪些條件能增大甲醇的產量( )
| A.增大容器體積 | B.增大壓強 | C.升高溫度 | D.加催化劑 |
一定條件下,在體積為3L的密閉容器中,一氧化碳與氫氣反應生成甲醇(催化劑為Cu2O/ZnO):CO(g)+ 2H2(g) CH3OH(g)
CH3OH(g)
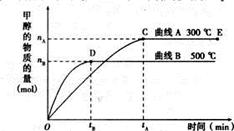
根據題意完成下列各題:
(1)5000C,從反應開始到平衡,甲醇的平均反應速率v(CH3OH)= (用nB、 tB 表示)
(2)在其他條件不變的情況下,將處于E點的體系的體積壓縮到原來的1/2,下列有關該體系的說法正確的是
a .氫氣的濃度減少 b.正反應速率加快,逆反應速率也加快
c.甲醇的物質的量增加 d.重新平衡時n(H2)/n(CH3OH)增大
(3)可逆反應:CO(g)+ 2H2(g) CH3OH(g) 在恒容密閉容器中反應,達到平衡狀態的標志是:
CH3OH(g) 在恒容密閉容器中反應,達到平衡狀態的標志是:
①單位時間內生成2n molH2的同時生成n mol CH3OH
②單位時間內生成2n molH2的同時,生成n mol CO
③用CO、H2、CH3OH 的物質的量濃度變化表示的反應速率的比為1 : 2 : 1的狀態
④混 合氣體的密度不再改變的狀態
⑤ 混合氣體的平均相對分子質量不再改變的狀態
(4)改變下列哪些條件能增大甲醇的產量( )
A.增大容器體積 B.增大壓強 C.升高溫度 D.加催化劑
(5)反應達到平衡后再升高溫度,K值 (填“增大”“減小”或“不變”)。
(6)據研究,反應過程中起催化作用的為Cu2O,反應體系中含少量CO2有利于維持催化劑Cu2O的量不變,原因是: (用化學方程式表示)。

| 序號 | 實驗內容要點 | 實驗現象, | 結論及解釋 | ||||
| (1) | 加熱后,緩慢通氣體 | E中澄清石灰水不變渾濁,G中澄清石灰水變渾濁 | 猜想 ① ① 成立 | ||||
| (2) | 將D裝置取走,連接好其余裝置, 繼續反應 |
觀察到E中澄清石灰水始終不 變渾濁 |
猜想 ⑦ ⑦ 不成立 | ||||
| (3) | 用pH試紙測C中混和物pH | pH試紙變為 淺紅或是紅 淺紅或是紅 色,pH=3 |
猜想④成立. | ||||
| (4) | 取C中適量混和液,滴加稍過量 碳酸氫鈉溶液蒸餾,取餾出物 碳酸氫鈉溶液蒸餾,取餾出物 ,再與銀氨溶液反應 |
出現銀鏡 | 猜想③成立,銀鏡反應離子方程式為 HCHO+2[Ag(NH3)2]++2OH-
HCHO+2[Ag(NH3)2]++2OH-
| ||||
| … | … | … |
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com