
題目列表(包括答案和解析)

| ||
| ||

| ||
| ||
| 1 |
| 10 |
| ||
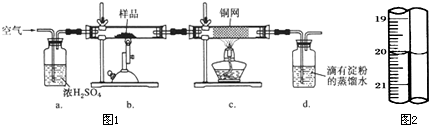
(14分)黃銅礦是工業煉銅的主要原料,其主要成分為CuFeS2,現有一種天然黃銅礦(含少量脈石SiO2),為了測定該黃銅礦的純度,某同學設計了如下實驗: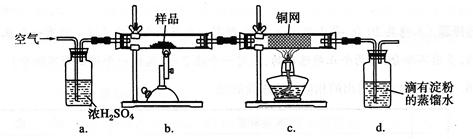

現稱取研細的黃銅礦樣品1.150 g,在空氣存在下進行煅燒,生成Cu、Fe2O3、FeO和SO2氣體,實驗后取d中溶液的1/10置于錐形瓶中,用0.05000 mol·L-1標準碘溶液進行滴定,初讀數為0.10 mL,末讀數如右圖所示。
(1)冶煉銅的反應為8CuFeS2+ 21O2 高溫8Cu + 4FeO + 2Fe2O3+ 16SO2,若CuFeS2中Fe的化合價為+2,反應中被還原的元素是 (填元素符號)。
(2)裝置a的作用是 。
| A.有利于空氣中氧氣充分反應 | B.除去空氣中的水蒸氣 |
| C.有利于氣體混合 | D.有利于觀察空氣流速 |


| A.有利于空氣中氧氣充分反應 | B.除去空氣中的水蒸氣 |
| C.有利于氣體混合 | D.有利于觀察空氣流速 |
1-5、CCABB 6-10、BCAD、BC 11-15、AC、DCCD 16-20、ADDDD 21、D
22【答案】(14分)
(1)Cu、O
(2)b、c
(3)2Fe3++2I-=2Fe2++I2 S2O82-+2Fe2+=2SO42-+2Fe3+(離子方程式不配平不扣分)
(4)a:稀硫酸、KMnO4溶液
b:稀硫酸浸取爐渣所得溶液能使KMnO4溶液褪色
23【答案】(14分)
(1)①鐵屑 ②稀硫酸 ③稀硝酸 ④氫氧化鈉 ⑤氫氧化鈉
(2)Fe+2H+=Fe2++H2↑ 2Fe3++Fe=3Fe2+
Cu2++Fe=Cu+Fe2+ 2Au3++3Fe=2Au+3Fe2+
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(3)Fe2O3 用作紅色涂料 用作制造銅鹽的原料
24【答案】(11分)(1)Cu2S (2)Cu2O,Cu2S (3)形成酸雨,會對植物和建筑物造成嚴重損害 硫酸 硫酸銨 電解池中,粗銅作陽極,精銅作陰極,電解質為硫酸銅溶液。陽極上發生氧化反應,Cu失去電子,使Cu單質變為Cu2+進入溶液中Cu-2e- === Cu2+;陰極上發生還原反應,Cu2+得到電子在陰極上析出Cu單質,Cu2++2e- === Cu,從而達到精制Cu的目的 (5)A D
25【答案】(8分)(1)Cu + H2O2 + H2SO4 == CuSO4 + 2H2O
(2)4Fe2+ + O2 + 4H+ == 4Fe3+ + 2H2O 2Fe3+ + 2I― == 2Fe2+ + I2
(3)10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O
26【答案】(10分)(1)B 目的是除去空氣中的水蒸氣,避免反應④發生;D 目的是除去空氣中的CO2,避免反應③發生;F 目的是除去空氣中的O2,避免反應①發生。
(2)j→h→g→d→c→k→l(或l→k)→a→b(或b→a)
(3)制得的氮化鎂將不純 因為A裝置沒有排完空氣前就加熱會讓空氣中的氧氣、CO2、水蒸氣等與鎂反應
(4)將產物取少量置于試管中,加入適量水,將潤濕的紅色石蕊試紙置于試管口,如果能夠看到潤濕的紅色石蕊試紙變藍,則說明產物是氮化鎂
27【答案】(11分)(1)3、4、5、6 Fe-2e-=Fe2+(或2Fe-4e-=2Fe2+) O2+4e-+2H2O=4OH-(2)濕度、溫度、O2的濃度、電解質存在 (3)電鍍、發藍等表面覆蓋層,犧牲陽極的陰極保護法等(其他合理答案也給分)
28【答案】(1)2Fe3++Cu = 2Fe2++Cu2+。 (2)裝置圖:
 ;正極反應:Fe3++e- = Fe2+(或2Fe3++2e- = 2Fe2+);負極反應:Cu-2e- = Cu2+。 (3)①通入足量氯氣將Fe2+氧化成Fe3+;②加入CuO調節溶液的pH至3.2~4.7;③過濾[除去Fe(OH)3]。 (4)CuO+H2SO4 = CuSO4+H2O、 CuSO4+Fe = FeSO4+Cu;不銹鋼表面有紫紅色物質生成。
;正極反應:Fe3++e- = Fe2+(或2Fe3++2e- = 2Fe2+);負極反應:Cu-2e- = Cu2+。 (3)①通入足量氯氣將Fe2+氧化成Fe3+;②加入CuO調節溶液的pH至3.2~4.7;③過濾[除去Fe(OH)3]。 (4)CuO+H2SO4 = CuSO4+H2O、 CuSO4+Fe = FeSO4+Cu;不銹鋼表面有紫紅色物質生成。
29【答案】(1)2Al+6H+ = 2Al3++3H2↑或2Al+3Cu2+ = 2Al3++3Cu;
2Cu+O2+H2O+CO2 = Cu2(OH)2CO3。
(2)白色沉淀生成,后沉淀逐漸溶解至消失。
Al3++3OH- = Al(OH)3↓,
Al(OH)3+OH- = AlO2- +2H2O。
(3)①3MnO2+4Al 3Mn+2Al2O3。
3Mn+2Al2O3。
②MnO2+H2O2+2H+ = Mn2++O2↑+2H2O。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com