28、水是寶貴的自然資源,在工農業生產和日常生活中有著極其廣泛的應用.
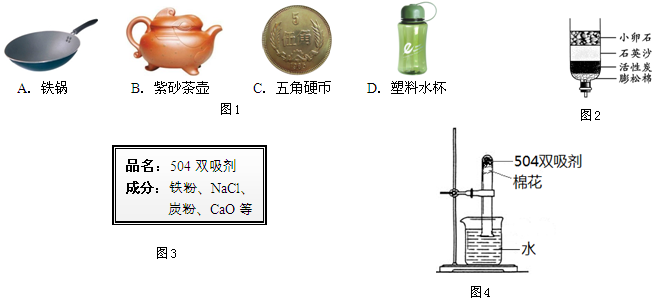
(1)自來水的生產過程大體如圖:
上圖過濾池中有活性炭層,活性炭起
吸附
作用,該過程中發生
物理
變化.氯化時,通常通入一定量氯氣,它與水反應生成鹽酸和次氯酸.實驗室配制AgNO
3溶液時不宜使用自來水,其原因是(用化學方程式表示)
AgNO3+HCl═AgCl↓+HNO3
.
(2)電解水時,加入少量NaOH可以增強水的導電性.現將0.1gNaOH溶解在99.9g水里,接通直流電源后,與電源正極相連的一端放出的氣體是
O2
,當溶液中NaOH的質量分數變為0.2%時,有
50g
水被分解.
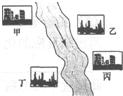
(3)在河旁有甲、乙、丙、丁四座工廠(位置如右圖所示),每個工廠排出的廢液只含有Na
2CO
3、FeCl
3、NaOH、HCl中的一種.某環保小組對河水監測時發現:甲處河水呈無色;乙處河水呈紅褐色;丙處河水由渾變清;丁處產生氣泡,河水澄清.請回答:
①甲工廠排出的廢液是一種堿性物質,檢驗該物質呈堿性可選用的試劑是
酚酞試液
.
②乙處河水呈紅褐色的化學方程式是
FeCl3+3NaOH═Fe(OH)3↓+3NaCl
.
③丁處產生氣泡的化學方程式是
Na2CO3+2HCl═2NaCl+H2O+CO2↑
.



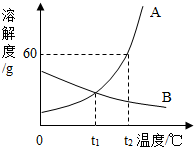 如圖是A、B兩種固體物質的溶解度曲線.
如圖是A、B兩種固體物質的溶解度曲線.