
題目列表(包括答案和解析)
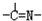 三種基團,無環狀結構,三種基團的數目關系為n3=
三種基團,無環狀結構,三種基團的數目關系為n3=

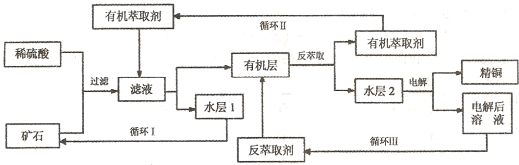
現代社會中銅在電氣、交通、機械和冶金、能源及石化工業、高科技等領域有廣泛的應用。某銅礦石含氧化銅、氧化亞銅、三氧化二鐵和脈石(Si02) ,現采用酸浸法從礦石中提取銅,其工藝流程圖如下。其中銅的萃取(銅從水層進人有機層的過程)和反萃取(銅從有機層進人水層的過程)是現代濕法煉銅的重要工藝手段。

已知:①Cu2O+2H+=Cu2++Cu + H2O;②當礦石中三氧化二鐵含量太低時,可用硫酸和硫酸鐵的混合液浸出銅;③反萃取后的水層2是硫酸銅溶液。回答下列問題:
(1)礦石用稀硫酸處理過程中發生反應的離子方程式為:Cu2O+2H+=Cu2++Cu + H2O、
、 。(寫出其中2個)
(2)“循環I”經多次循環后的水層1不能繼續循環使用,但可分離出一種重要的硫酸鹽晶體.若水層1暴露在空氣中一段時間后,可以得到另一種重要的硫酸鹽,寫出水層l暴露在空氣中發生反應的離子方程式 。
(3)“循環n”中萃取劑是一類稱作為肟類的有機化合物,如N-510、N-530等。某肟類化合物A的分子結構中僅含n1個-CH3、n2個-OH和n3個![]() 三種基團,無環狀結構,三種基團的數目關系為n3= 。若A的相對分子質量為116,上述基團連接時碳原子跟碳原子相連,則A的結構簡式是 。
三種基團,無環狀結構,三種基團的數目關系為n3= 。若A的相對分子質量為116,上述基團連接時碳原子跟碳原子相連,則A的結構簡式是 。
(4)寫出電解過程中陽極(惰性電極)發生反應的電極反應式 。
(5)該工藝最大亮點是它符合下列原理 (填字母,下同)。
A.化學平衡 B.綠色化學 C.質量守恒 D.能量守恒
E.相似相溶 F.酸堿中和 G.氧化還原反應
(6)銅、銀、金是人類認識最早的三種金屬,因為很早就被人們用作錢幣,因而有“貨幣金屬”之稱。由于鐵的金屬性比銅、銀、金強,相對而言,人類認識鐵稍晚。某研究性學習小組為了證明鐵的金屬活動性比銅強,他設計了如下方案:①鐵片置于硫酸銅溶液中有銅析出;②鐵、銅和氯氣反應分別生成FeCl3和CuCl2;③足量的鐵粉和銅粉和濃硫酸反應生成FeSO4和CuSO4;④銅片置于FeCl3溶液中銅片逐漸溶解;⑤把鐵片和銅片置于盛有稀硫酸的燒杯中,交用導線連接,鐵片上無氣泡產生,而銅片上有氣泡產生;⑥把鐵片和銅片置于盛有濃硝酸的燒杯中,并用導線連接,鐵片上有氣泡產生,而銅片上無氣泡產生。以上設計合理的有 。
A.兩種方案 B.三種方案 C.四種方案 D.五種方案
(10分)下圖是一個電化學過程的示意圖。
請回答下列問題:
(1)圖中甲池的名稱 (填“原電池”“電解池”或“電鍍池”)。
(2)寫出通入CH3OH的電極的電極反應式: 。
(3)乙池中反應的化學方程式為 ,當乙池中B極的質量增加5.4g時,甲池中理論上消耗O2的體積為 L(標準狀況下),此時丙池中 電極(填“C”或“D”)析出1.6g某金屬,則丙池的某鹽溶液可能是 (填序號)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液
【解析】(1)甲屬于燃料電池,給乙池和丙池供電。在燃料電池中可燃物在負極通入,所以電極反應式為CH3OH+8OH――6e-=CO32-+6H2O。電極A和電池的正極相連,所以A是陽極、B是陰極、C是陽極、D是陰極。A是惰性電極,所以乙池中反應式為4AgNO3+2H2O 4Ag+O2↑+4HNO3。5.4g是單質銀,轉移的電子是
![]() ,所以根據得失電子守恒可知氧氣的物質的量是
,所以根據得失電子守恒可知氧氣的物質的量是![]() 。金屬陽離子只有在陰極放電,所以在D電極放電。鎂和鈉屬于活潑的金屬,在水溶液中其離子不可能放電。1.6g若是銅,則轉移的電子為
。金屬陽離子只有在陰極放電,所以在D電極放電。鎂和鈉屬于活潑的金屬,在水溶液中其離子不可能放電。1.6g若是銅,則轉移的電子為![]() ,正確。若是銀,則說明硝酸銀不足,還有氫氣生成,所以答案是BD。
,正確。若是銀,則說明硝酸銀不足,還有氫氣生成,所以答案是BD。
(10分)下圖是一個電化學過程的示意圖。

請回答下列問題:
(1)圖中甲池的名稱 (填“原電池”“電解池”或“電鍍池”)。
(2)寫出通入CH3OH的電極的電極反應式: 。
(3)乙池中反應的化學方程式為 ,當乙池中B極的質量增加5.4g時,甲池中理論上消耗O2的體積為 L(標準狀況下),此時丙池中 電極(填“C”或“D”)析出1.6g某金屬,則丙池的某鹽溶液可能是 (填序號)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液
【解析】(1)甲屬于燃料電池,給乙池和丙池供電。在燃料電池中可燃物在負極通入,所以電極反應式為CH3OH+8OH――6e-=CO32-+6H2O。電極A和電池的正極相連,所以A是陽極、B是陰極、C是陽極、D是陰極。A是惰性電極,所以乙池中反應式為4AgNO3+2H2O
 4Ag+O2↑+4HNO3。5.4g是單質銀,轉移的電子是
4Ag+O2↑+4HNO3。5.4g是單質銀,轉移的電子是 ,所以根據得失電子守恒可知氧氣的物質的量是
,所以根據得失電子守恒可知氧氣的物質的量是 。金屬陽離子只有在陰極放電,所以在D電極放電。鎂和鈉屬于活潑的金屬,在水溶液中其離子不可能放電。1.6g若是銅,則轉移的電子為
。金屬陽離子只有在陰極放電,所以在D電極放電。鎂和鈉屬于活潑的金屬,在水溶液中其離子不可能放電。1.6g若是銅,則轉移的電子為 ,正確。若是銀,則說明硝酸銀不足,還有氫氣生成,所以答案是BD。
,正確。若是銀,則說明硝酸銀不足,還有氫氣生成,所以答案是BD。
(11分)某溶液僅含下表離子中的5種(不考慮水的電離及離子的水解)且各種離子物質的量均為1mol。
陽離子:Na+ Mg2+ Fe3+ Al3+ Fe2+
陰離子:OH- CO32- Cl- NO3- SO42-
①若向溶液中加入KSCN溶液無明顯變化;
②若向原溶液中加入稀鹽酸,有無色氣體生成,溶液中陰離子種類不變;請推斷:
(1)原溶液中含有陽離子:________;含有陰離子:__________;
(2)向原溶液中加入足量稀鹽酸發生反應的離子方程式:______ ___ _ ;
(3)若向原溶液中加入足量的NaOH溶液,充分反應后過濾,洗滌,灼燒至恒重,得到的固體質量為__________g。
【解析】①說明沒有Fe3+。加入鹽酸陰離子種類不變,所以溶液中不能含有CO32-和OH-。又因為生成無色氣體,在所給的離子中只有通過硝酸根的還原才能生成NO,所以原溶液中一定含有NO3-。所以必須有還原性離子,即一定含有亞鐵離子。因為物質的量均是1mol,且只有5種離子,所以若鎂離子、鈉離子和鋁離子同時存在,或存在2種,都不能滿足溶液呈電中性,所以三者只能含有一種,因此氯離子和SO42-必須同時存在。根據離子的濃度大小可以判斷,鎂離子存在,鋁離子和鈉離子不能存在。若加入足量的氫氧化鈉溶液,最終生成的沉淀是氫氧化鎂和氫氧化鐵,灼燒得到氧化鎂和氧化鐵,根據原子守恒可知,質量是1mol×40g/mol+0.5mol×160g/mol=120g。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com