
題目列表(包括答案和解析)
某化學興趣小組測定某Fe2(SO4)3樣品(只含少量FeCl2雜質)中鐵元素的質量分數,按以下實驗步驟進行操作:
①稱取a g樣品,置于燒杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸餾水,使樣品溶解,然后準確配制成250.00 mL溶液;
③量取25.00 mL步驟②中配得的溶液,置于燒杯中,加入適量的氯水,使反應完全;
④加入過量氨水,充分攪拌,使沉淀完全;
⑤過濾,洗滌沉淀;
⑥將沉淀轉移到某容器內,加熱、攪拌,直到固體由紅褐色全部變為紅棕色后,在干燥器中冷卻至室溫后,稱量;
⑦……
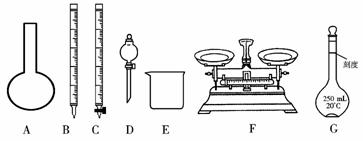
請根據上面敘述,回答:
(1)上圖所示儀器中,本實驗步驟①②③中必須用到的儀器有E和____________(填字母)。
(2)步驟②中:配制50 mL,1.0 mol/L稀H2SO4需要98%(密度1.84 g/cm3)的濃H2SO4體積為____________ mL,量取該體積的濃H2SO4用到量筒規格是____________。
(3)樣品中的雜質Fe2+有較強的還原性,完成并配平下列反應的離子方程式
□Fe2++□ClO2□□=□Fe3++□Cl-+□H2O
從理論上分析,上述實驗中若將氯水改為ClO2時,對實驗結果造成____________(填“偏大”“偏小”或“不影響”),等物質的量的ClO2與Cl2的氧化效率之比為____________。
(4)第⑥步的操作中,將沉淀物轉移到____________(填儀器名稱)中加熱,冷卻至室溫,稱量其質量為m1 g,再次加熱并冷卻至室溫稱量其質量為m2 g,若m1與m2差值較大,接下來的操作應當是____________。
(5)若步驟⑥不在干燥器中冷卻,則測定的鐵元素的質量分數會____________(填“偏大”“偏小”或“不影響”);若容器質量是W1 g,最終容器和固體的總質量是W2 g,則樣品中鐵元素的質量分數為____________(列出算式,不需化簡)。
某化學興趣小組測定某Fe2(SO4)3樣品(只含少量FeCl2雜質)中鐵元素的質量分數,按以下實驗步驟進行操作:
①稱取a g樣品,置于燒杯中;
②加入50 mL 1.0 mol/L稀硫酸和一定量的蒸餾水,使樣品溶解,然后準確配制成250.00 mL溶液;
③量取25.00 mL步驟②中配得的溶液,置于燒杯中,加入適量的氯水,使反應完全;
④加入過量氨水,充分攪拌,使沉淀完全;
⑤過濾,洗滌沉淀;
⑥將沉淀轉移到某容器內,加熱、攪拌,直到固體由紅褐色全部變為紅棕色后,在干燥器中冷卻至室溫后,稱量;
⑦……Ks5u

請根據上面敘述,回答:
(1)上圖所示儀器中,本實驗步驟①②③中必須用到的儀器有E和____________(填字母)。
(2)步驟②中:配制50 mL,1.0 mol/L稀H2SO4需要98%(密度1.84 g/cm3)的濃H2SO4體積為____________ mL,量取該體積的濃H2SO4用到量筒規格是____________。
(3)樣品中的雜質Fe2+有較強的還原性,完成并配平下列反應的離子方程式
□Fe2++□ClO2+□□=□Fe3++□Cl-+□H2O
從理論上分析,上述實驗中若將氯水改為ClO2時,對實驗結果造成____________(填“偏大”“偏小”或“不影響”),等物質的量的ClO2與Cl2的氧化效率之比為____________。
(4) 若步驟⑥不在干燥器中冷卻,則測定的鐵元素的質量分數會____________(填“偏大”“偏小”或“不影響”);第⑥步的操作中,將沉淀物冷卻至室溫,稱量其質量為m1 g,再次加熱并冷卻至室溫稱量其質量為m2 g,若m1與m2差值較大,接下來的操作應當是___________________。
(20分)某化學課外活動小組以鋁屑、稀H2SO4、NaOH溶液為主要原料欲制備Al(OH)3沉淀,設計了如下三種方案,見下表。閱讀下表并回答下列問題:
| 途徑 | 生成1 mol Al(OH)3消耗H+或OH-的物質的量/mol | |
| 消耗H+ | 消耗OH- | |
| 1.Al→Al3+→Al(OH)3 | | |
2.Al→AlO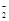 →Al(OH)3 →Al(OH)3 | | |
3.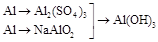 | | |
 (g)NaOH固體。他在托盤天平的右盤上放入(
(g)NaOH固體。他在托盤天平的右盤上放入(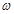 + y)(g)砝碼,在左盤的表面皿中加入NaOH固體,這時指針偏向右邊,如圖所示,下面他的操作應該是_________ 使 。
+ y)(g)砝碼,在左盤的表面皿中加入NaOH固體,這時指針偏向右邊,如圖所示,下面他的操作應該是_________ 使 。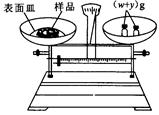
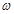 (g)NaOH剛好可配制0.5mol·L-1NaOH溶液500mL。在下列配制溶液過程示意圖中有錯誤的是(填操作序號)______________。
(g)NaOH剛好可配制0.5mol·L-1NaOH溶液500mL。在下列配制溶液過程示意圖中有錯誤的是(填操作序號)______________。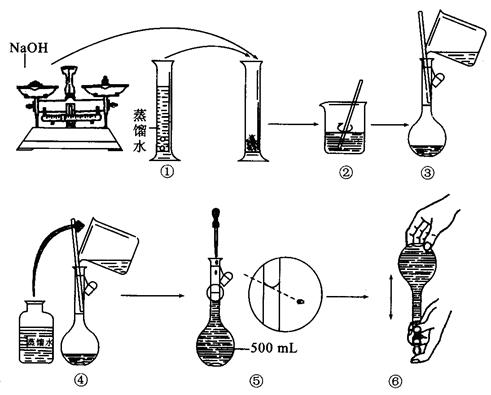
 NaOH溶液,再加入足量鋁屑。給溶液稍加熱。其作用是:__________________________用蒸餾水把鋁屑沖洗干凈。稱量鋁屑的質量為m1(g)。
NaOH溶液,再加入足量鋁屑。給溶液稍加熱。其作用是:__________________________用蒸餾水把鋁屑沖洗干凈。稱量鋁屑的質量為m1(g)。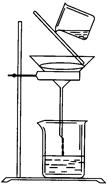
(20分)某化學課外活動小組以鋁屑、稀H2SO4、NaOH溶液為主要原料欲制備Al(OH)3沉淀,設計了如下三種方案,見下表。閱讀下表并回答下列問題:
|
途徑 |
生成1 mol Al(OH)3消耗H+或OH-的物質的量/mol |
|
|
消耗H+ |
消耗OH- |
|
|
1.Al→Al3+→Al(OH)3 |
|
|
|
2.Al→AlO |
|
|
|
3. |
|
|
(1)填寫上表中空格并從節約原料的角度來分析,你認為應選擇方案_________最為合理。
(2)本實驗要用到NaOH溶液。某學生用已知質量y(g)的表面皿,準確稱取 (g)NaOH固體。他在托盤天平的右盤上放入(
(g)NaOH固體。他在托盤天平的右盤上放入( + y)(g)砝碼,在左盤的表面皿中加入NaOH固體,這時指針偏向右邊,如圖所示,下面他的操作應該是_________ 使
。
+ y)(g)砝碼,在左盤的表面皿中加入NaOH固體,這時指針偏向右邊,如圖所示,下面他的操作應該是_________ 使
。

(3)若稱取的 (g)NaOH剛好可配制0.5mol·L-1NaOH溶液500mL。在下列配制溶液過程示意圖中有錯誤的是(填操作序號)______________。
(g)NaOH剛好可配制0.5mol·L-1NaOH溶液500mL。在下列配制溶液過程示意圖中有錯誤的是(填操作序號)______________。

(4)閱讀下列制備Al(OH)3實驗步驟,填寫空白:
①在燒杯A中加入50mL0.5mol·L NaOH溶液,再加入足量鋁屑。給溶液稍加熱。其作用是:__________________________用蒸餾水把鋁屑沖洗干凈。稱量鋁屑的質量為m1(g)。
NaOH溶液,再加入足量鋁屑。給溶液稍加熱。其作用是:__________________________用蒸餾水把鋁屑沖洗干凈。稱量鋁屑的質量為m1(g)。
②在盛有適量稀H2SO4的燒杯B中應放入___________(g)(用含m1的式子表示)質量的鋁屑,充分攪拌使鋁屑反應完全。
③在盛有適量濃NaOH溶液的燒杯C中放入____________(g)(用含m1的式子表示)質量的鋁屑充分攪拌使鋁屑反應完全。
④將燒杯B和燒杯C中的溶液混和觀察到的現象是:_______________________________,反應的離子方程式是:___________________________
(5)過濾時某學生操作如圖,請用文字說明圖中錯誤的是:
_____________________ 。

(6)把沉淀轉移到燒杯中,用蒸餾水洗滌三次再過濾,再洗滌、
干燥得Al(OH)3固體質量為m2(g)計算本實驗Al(OH)3的產率是_________________
(本題共15分)
有4種質量比可能相同或不同的鎂鋁合金樣品①、②、③、④。甲、乙、丙、丁4位同學各取1種樣品,進行下列實驗,測定合金中鎂的質量分數。
52.甲同學取樣品①m1 g和過量的氫氧化鈉溶液反應,然后過濾;再往濾液中通入過量的二氧化碳氣體,將所得沉淀過濾、洗滌、烘干、灼燒,得到固體質量仍為m1 g。則樣品①合金中鎂的質量分數為_____________。
53.乙同學取樣品②m2 g和足量的鹽酸反應,然后滴加過量的氫氧化鈉溶液,將沉淀過濾、洗滌、烘干、灼燒,得到固體質量仍為m2 g。則樣品②合金中鎂的質量分數為____________。
54.丙同學取樣品③m3 g和足量的稀硫酸反應,發現固體完全溶解,標準狀況下得到氣體體積為V L,則樣品③中m3的取值范圍是___________________________________________。
丁同學取不同質量的樣品④分別和30 mL同濃度的鹽酸反應,所取合金質量與產生氣體體積(已轉化為標準狀況)如下:
| 實驗序號 | a | b | c |
| 合金質量/mg | 510 | 765 | 918 |
| 氣體體積/mL | 560 | 672 | 672 |
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com