
題目列表(包括答案和解析)
用0.1mol/LNaOH溶液滴定0.1mol/LHCl,如達到滴定終點時不慎多加了1滴NaOH溶液(1滴溶液的體積約為0.05ml),繼續加水至50ml,所得溶液的PH是
A.4 B.7.2 C.10 D.11.3
 (08上海松江區模擬)乙酸乙酯是重要的工業原料和溶劑。現利用如圖
(08上海松江區模擬)乙酸乙酯是重要的工業原料和溶劑。現利用如圖
裝置制取乙酸乙酯粗產品,再測定乙酸乙酯的含量。
⑴寫出此反應的化學方程式
;
該反應要在濃硫酸存在的條件下進行,濃硫酸的作用是
;
⑵實驗室一般用飽和碳酸鈉溶液接收反應的生成物。若不
振蕩該試管,可看到的現象是 ,若振
蕩該試管,可看到的現象是 ,但有時卻出現了白色晶體,該晶體是 ;
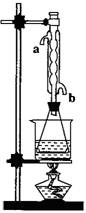 ⑶對于制乙酸乙酯的上述裝置,為了提高產率,請提出
⑶對于制乙酸乙酯的上述裝置,為了提高產率,請提出
一條改進意見:
。
⑷為測定乙酸乙酯的含量,進行了如下操作:
(I)準確稱量20.0g乙酸乙酯粗品于錐形瓶中,用0.50mol/L
NaOH滴定(酚酞做指示劑)。終點時消耗NaOH溶液的體積為
40.0mL;
(II)另取20.0g乙酸乙酯粗產品于250mL錐形瓶中,加入100mL
2.1mol/LNaOH溶液混合均勻后,裝上冷凝管,在水浴上加熱回
流約1小時,裝置如圖所示。待冷卻后,用0.50mol/LHCl滴定
過量的NaOH。終點時消耗鹽酸的體積為20.0mL。
回答:
①實驗(I)中達到滴定終點時的現象是 。
②實驗(II)中冷水從冷水凝管的 (填a或b)管口通入。
③利用實驗(I)、(II)測量的數據計算粗產物中乙酸乙酯的質量分數為 。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com