
題目列表(包括答案和解析)
(1)化學平衡常數K表示可逆反應的進行程度,K值越大,表示可逆反應進行得越完全,K值大小與溫度的關系是:溫度升高,K值________(填“一定增大”“一定減小”或“可能增大也可能減小”).
(2)在一體積為10 L的容器中,通入一定量的CO和H2O,在800℃時發生如下反應:
CO(g)+H2O(g)
①0-4 min間平均反應速率v(CO)=________mol·L-1·min-1
②在800℃時該反應的化學平衡常數K=________(要求寫出表達式及數值);CO的轉化率=________.
③在800℃時,若反應開始時此容器中CO和H2O的濃度分別為0.20 mol/L和0.80 mol/L,則達到平衡時CO轉化為CO2的轉化率是:________.
(3)
25℃時,Ksp=5.61×10-12,Ksp=7.42×10-11.下列說法正確的是________A.25℃時,飽和Mg(OH)2溶液與飽和MgF2溶液相比,c(Mg2+)后者大
B.25℃時,在Mg(OH)2的懸濁液中加入少量的NH4Cl固體,c(Mg2+)減小
C.25℃時,Mg(OH)2固體在20 mL 0.01 mol·L-1氨水中的Ksp和在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp相等
D.25℃時,在Mg(OH)2懸濁液中加入NaF溶液后,Mg(OH)2可能轉化為MgF2
E.25℃時,
某飽和Mg(OH)2溶液中c(Mg2+)=0.0561 mol·L-1,則溶液的pH=9(4)根據化學反應速率與化學平衡理論,聯系化工生產實際,你認為下列說法不正確的是________.
A.化學反應速率理論可指導怎樣在一定時間內快出產品
B.有效碰撞理論可指導怎樣提高原料的轉化率
C.勒夏特列原理可指導怎樣使用有限原料多出產品
D.催化劑的使用是提高產品率的有效方法
E.正確利用化學反應速率和化學反應限度都可以提高化工生產的綜合經濟效益
(1)化學平衡常數K表示可逆反應的進行程度,K值越大,表示可逆反應進行得越完全,K值大小與溫度的關系是:溫度升高,K值_______________(填“一定增大”“一定減小”或“可能增大也可能減小”)。
(2)在一體積為10L的容器中,通入一定量的CO和H2O,在800℃時發生如下反應:
CO(g)+H2O (g) ![]() CO2(g)+H2 (g) △H<0
CO2(g)+H2 (g) △H<0
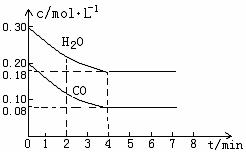
CO和H2O物質的量濃度變化如下圖(a)所示,則:
① 0-4min間平均反應速率v(CO)=________ mol??L-1??min-1
②在800℃時該反應的化學平衡常數K=___________________________(要求寫出表達式及數值);CO的轉化率=______________。

圖(a)
③在800℃時,若反應開始時此容器中CO和H2O的濃度分別為0.20 mol/L和0.80 mol/L,則達到平衡時CO轉化為CO2的轉化率是:______________________。
(3)25℃時,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列說法正確的是_______
A.25℃時,飽和Mg(OH)2溶液與飽和MgF2溶液相比, c(Mg2+)后者大
B.25℃時,在Mg(OH)2的懸濁液中加入少量的NH4Cl固體,c(Mg2+)減小
C.25℃時,Mg(OH)2固體在20mL0.01mol·L-1氨水中的Ksp和在20mL0.01 mol·L-1
NH4Cl溶液中的Ksp相等
D.25℃時,在Mg(OH)2懸濁液中加入NaF溶液后,Mg(OH)2可能轉化為MgF2
E.25℃ 時,某飽和Mg(OH)2溶液中c(Mg2+)=0.0561mol·L-1,則溶液的pH=9
(4)根據化學反應速率與化學平衡理論,聯系化工生產實際,你認為下列說法不正確的是 。
A.化學反應速率理論可指導怎樣在一定時間內快出產品
B.有效碰撞理論可指導怎樣提高原料的轉化率
C.勒夏特列原理可指導怎樣使用有限原料多出產品
D.催化劑的使用是提高產品率的有效方法
E.正確利用化學反應速率和化學反應限度都可以提高化工生產的綜合經濟效益
(1)化學平衡常數K表示可逆反應的進行程度,K值越大,表示可逆反應進行得越完全,K值大小與溫度的關系是:溫度升高,K值_______________(填“一定增大”“一定減小”或“可能增大也可能減小”)。
(2)在一體積為10L的容器中,通入一定量的CO和H2O,在800℃時發生如下反應:
CO(g)+H2O (g) ![]() CO2(g)+H2 (g) △H<0
CO2(g)+H2 (g) △H<0
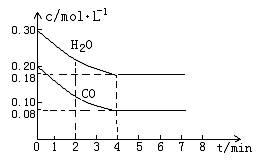
CO和H2O物質的量濃度變化如下圖(a)所示,則:
① 0-4min間平均反應速率v(CO)=________ mol•L-1•min-1
②在800℃時該反應的化學平衡常數K=___________________________(要求寫出表達式及數值);CO的轉化率=______________。
圖(a)
③在800℃時,若反應開始時此容器中CO和H2O的濃度分別為0.20 mol/L和0.80 mol/L,則達到平衡時CO轉化為CO2的轉化率是:______________________。
(3)25℃時,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列說法正確的是_______
A.25℃時,飽和Mg(OH)2溶液與飽和MgF2溶液相比, c(Mg2+)后者大
B.25℃時,在Mg(OH)2的懸濁液中加入少量的NH4Cl固體,c(Mg2+)減小
C.25℃時,Mg(OH)2固體在20mL0.01mol·L-1氨水中的Ksp和在20mL0.01 mol·L-1
NH4Cl溶液中的Ksp相等
D.25℃時,在Mg(OH)2懸濁液中加入NaF溶液后,Mg(OH)2可能轉化為MgF2
E.25℃ 時,某飽和Mg(OH)2溶液中c(Mg2+)=0.0561mol·L-1,則溶液的pH=9
(4)根據化學反應速率與化學平衡理論,聯系化工生產實際,你認為下列說法不正確的是 。
A.化學反應速率理論可指導怎樣在一定時間內快出產品
B.有效碰撞理論可指導怎樣提高原料的轉化率
C.勒夏特列原理可指導怎樣使用有限原料多出產品
D.催化劑的使用是提高產品率的有效方法
E.正確利用化學反應速率和化學反應限度都可以提高化工生產的綜合經濟效益
(14分)(1)化學平衡常數K表示可逆反應的進行程度,K值越大,表示可逆反應進行得越完全,K值大小與溫度的關系是:溫度升高,K值_______________(填“一定增大”“一定減小”或“可能增大也可能減小”)。
(2)在一體積為10L的容器中,通入一定量的CO和H2O,在800℃時發生如下反應:
CO(g)+H2O (g) ![]() CO2(g)+H2 (g) △H<0
CO2(g)+H2 (g) △H<0
CO和H2O物質的量濃度變化如下圖(a)所示,則:
① 0-4min間平均反應速率v(CO)=________ mol??L-1??min-1
②在800℃時該反應的化學平衡常數K=___________________________(要求寫出表達式及數值);CO的轉化率=______________。
圖(a)
③在800℃時,若反應開始時此容器中CO和H2O的濃度分別為0.20 mol/L和0.80 mol/L,則達到平衡時CO轉化為CO2的轉化率是:______________________。
(3)25℃時,Ksp[Mg(OH)2]=5.61×10-12,Ksp[MgF2]=7.42×10-11。下列說法正確的是_______
A.25℃時,飽和Mg(OH)2溶液與飽和MgF2溶液相比, c(Mg2+)后者大
B.25℃時,在Mg(OH)2的懸濁液中加入少量的NH4Cl固體,c(Mg2+)減小
C.25℃時,Mg(OH)2固體在20mL0.01mol·L-1氨水中的Ksp和在20mL0.01 mol·L-1
NH4Cl溶液中的Ksp相等
D.25℃時,在Mg(OH)2懸濁液中加入NaF溶液后,Mg(OH)2可能轉化為MgF2
E.25℃ 時,某飽和Mg(OH)2溶液中c(Mg2+)=0.0561mol·L-1,則溶液的pH=9
(4)根據化學反應速率與化學平衡理論,聯系化工生產實際,你認為下列說法不正確的是 。
A.化學反應速率理論可指導怎樣在一定時間內快出產品
B.有效碰撞理論可指導怎樣提高原料的轉化率
C.勒夏特列原理可指導怎樣使用有限原料多出產品
D.催化劑的使用是提高產品率的有效方法
E.正確利用化學反應速率和化學反應限度都可以提高化工生產的綜合經濟效益
 鹵素單質的性質活潑,鹵素的化合物應用廣泛,研究鹵素單質及其化合物具有重要意義.
鹵素單質的性質活潑,鹵素的化合物應用廣泛,研究鹵素單質及其化合物具有重要意義. WI2(g).為模擬上述反應,準確稱取0.508g碘、0.736g金屬鎢置于50.0mL
WI2(g).為模擬上述反應,準確稱取0.508g碘、0.736g金屬鎢置于50.0mL
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com