
題目列表(包括答案和解析)
 CO2、SO2、NOx是對環境影響較大的氣體,控制和治理CO2、SO2、NOx是解決溫室效應、減少酸雨和光化學煙霧的有效途徑.
CO2、SO2、NOx是對環境影響較大的氣體,控制和治理CO2、SO2、NOx是解決溫室效應、減少酸雨和光化學煙霧的有效途徑.| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
近年來,碳和碳的化合物在生產生活實際中應用廣泛。
(1)在2升的密閉容器中,充有2mol CO與4mol 水蒸氣,在催化劑作用下進行如下化學反應:CO(g)+H2O(g) CO2(g)+H2(g),CO的轉化率和溫度t的關系如下表:
CO2(g)+H2(g),CO的轉化率和溫度t的關系如下表:
|
t(℃) |
750 |
850 |
1000 |
|
CO% |
0.7 |
2/3 |
0.5 |
1000℃時該反應的平衡常數為___________________。850℃時,向該容器中重新通入1mol CO、1.5mol H2O、0.5mol CO2和2molH2,此時反應___________(填“向右進行”、“向左進行”或“處于平衡狀態”)。
(2)已知:C(s)+O2 (g) ===CO2(g) △H1=﹣393.5kJ·mol-1
2H2(g)+O2(g)=== 2H2O(g) △H2=﹣483.6kJ·mol-1
C(s)+H2O(g)=== CO(g)+H2(g) △H3=+131.3kJ·mol-1
則CO和H2O生成CO2和H2的熱化學方程式為_______________________________。
(3) 目前工業上可用CO2來生產燃料甲醇,有關反應為:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。現向體積為1 L的密閉容器中,充入
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。現向體積為1 L的密閉容器中,充入
1mol CO2和3mol H2,反應過程中測得CO2和CH3OH(g)的濃度隨時間的變化如圖所示。

①從反應開始到平衡,氫氣的平均反應速率v(H2)=_____________;
②若改變條件使平衡向正反應方向移動,則平衡常數______________(填序號)
a.可能不變 b.可能減小 c.可能增大 d.不變、減小、增大皆有可能
(4)NaHCO3的水溶液呈堿性,其原因是(用文字敘述)_______________________。常溫下,向100mL
0.2mol/LNaHCO3溶液中滴加amol/L的醋酸溶液,當滴加到溶液呈中性時,所用去的醋酸體積剛好也
為100mL,此時醋酸的電離常數為b, 用含b的代數式表示醋酸的濃度a=_____________________。
近年來,碳和碳的化合物在生產生活實際中應用廣泛。
(1)在2升的密閉容器中,充有2mol CO與4mol 水蒸氣,在催化劑作用下進行如下化學反應:CO(g)+H2O(g) CO2(g)+H2(g),CO的轉化率和溫度t的關系如下表:
CO2(g)+H2(g),CO的轉化率和溫度t的關系如下表:
| t(℃) | 750 | 850 | 1000 |
| CO% | 0.7 | 2/3 | 0.5 |
 CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。現向體積為1 L的密閉容器中,充入
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。現向體積為1 L的密閉容器中,充入
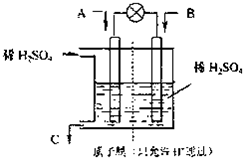 CO2、SO2、NOx是對環境影響較大的氣體,控制和治理CO2、SO2、NOx是解決溫室效應、減少酸雨和光化學煙霧的有效途徑.
CO2、SO2、NOx是對環境影響較大的氣體,控制和治理CO2、SO2、NOx是解決溫室效應、減少酸雨和光化學煙霧的有效途徑.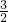 O2(g)═CO2(g)+2H2O(l)△H=-594.1kJ mol-1則表示液態甲醇燃燒熱的熱化學方程式為______.
O2(g)═CO2(g)+2H2O(l)△H=-594.1kJ mol-1則表示液態甲醇燃燒熱的熱化學方程式為______. O2(g)═CO2(g)+2H2O(l)△H=-594.1kJ mol-1則表示液態甲醇燃燒熱的熱化學方程式為______.
O2(g)═CO2(g)+2H2O(l)△H=-594.1kJ mol-1則表示液態甲醇燃燒熱的熱化學方程式為______.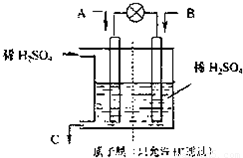
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com