某課外興趣小組的同學為了探究金屬X、Y、Z三種金屬的活動性順序,設計并完成了下圖所示的二組實驗:
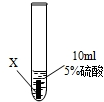
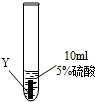
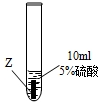
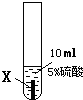
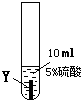
實驗一:把金屬X、Y、Z三種金屬分別放入溶液中
| 實驗 |
實驗步驟 |
實驗現象 |
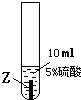
| ① |
|
X片表面無明顯變化 |
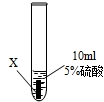
| ② |
|
Y片表面無明顯變化 |
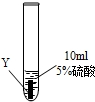
| ③ |
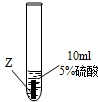
|
Z片溶解,表面有無色氫氣產生,溶液最終為無色 |
請你根據他們所做的實驗回答:
(1)Z與硫酸反應后,生成+3價金屬離子,寫出實驗③的化學方程式:______.
(2)通過上述實驗,你認為上述三種金屬最活潑是:______.
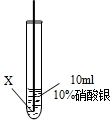
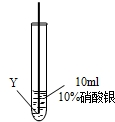
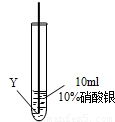
實驗二:把X、Y兩種金屬絲放入硝酸銀溶液中
| 實驗 |
實驗步驟 |
實驗現象 |
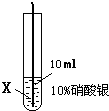
| ④ |
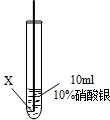
|
在X絲表面有銀白色的固體析出 |
| ⑤ |
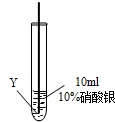
|
在Y絲表面沒有明顯現象 |
(3)通過實驗事實得出X、Y、Z金屬活動性由強到弱的順序為______.
實驗三:小組同學選擇“Z絲和硫酸反應的快慢與什么因素有關”的課題開展探究.下表是他們分別用相同質量的Z絲和足量稀硫酸反應的三組實驗數據:
| 實驗編號 |
硫酸的質量分數/% |
反應的溫度 |
Z絲消失的時間/S |
| ⑥ |
3 |
20 |
500 |
| ⑦ |
6 |
20 |
300 |
| ⑧ |
6 |
30 |
80 |
(4)實驗⑦和⑧表明:該反應快慢與______有關
(5)能表明硫酸濃度對反應快慢有影響的實驗編號是:______和______
(6)如果實驗⑥中硫酸的質量分數改為4%,請推出Z絲消失的時間(用t表示)的取值范圍_______
(7)該實驗除了用Z絲消失的時間來衡量反應的快慢外,你還能提出新的方法來衡量反應的快慢嗎?方法______.