
題目列表(包括答案和解析)
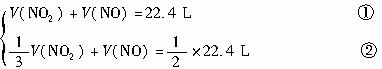
圖8-6?
(1)C中發生的反應,其化學方程式是 。已知原C中的氣體是單一氣體,它是 ,理由是 。?
(2)將反應后C筒內氣體用水充分吸收,在同溫同壓下,氣體體積減少一半,則與水反應前 C中的氣體是 。?
(3)若實驗開始前A、C中氣體體積(換算成標準狀況)分別為?
80℃,101.3 kPa下,用圖86裝置進行如下實驗。A、C兩筒內分別裝有無色氣體,它們可能是NH3、O2、N2、H2S、NO、CO2等氣體,B筒內裝有Na2O2固體,推動A的活塞使A筒內氣體緩緩地全部通過B后進入C筒,C筒內氣體由無色變為紅棕色,但其體積換算成同溫同壓下卻并未變化(不考慮2NO2![]() N2O4)。?
N2O4)。?
![]()
圖8-6?
(1)C中發生的反應,其化學方程式是 。已知原C中的氣體是單一氣體,它是 ,理由是 。?
(2)將反應后C筒內氣體用水充分吸收,在同溫同壓下,氣體體積減少一半,則與水反應前 C中的氣體是 。?
(3)若實驗開始前A、C中氣體體積(換算成標準狀況)分別為?1.40 L? 和2.24 L,且A中的氣體經過B管后,B管增重了?1.40 g?。經計算和推理可判定A中的氣體是 ,其質量為 g(不必寫出計算和推理過程)。?
| CH4 | SiH4 | NH3 | PH3 | |
| 沸點(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解溫度(K) | 873 | 773 | 1073 | 713.2 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 電負性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
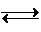 CO(g)+3H2(g)△H=+206.1kJ?mol-1.
CO(g)+3H2(g)△H=+206.1kJ?mol-1.| CH4 | H2O | CO | H2 |
| 3.0mol?L-1 | 8.5mol?L-1 | 2.0mol?L-1 | 2.0mol?L-1 |
| 實驗序號 | 溫度/℃ | 壓強/kPa | CH4初始濃度/mol?L-1 | H2O初始濃度/mol?L-1 | K |
| 1 | 360 | P | 2.00 | 6.80 | K1 |
| 2 | t | 101 | 2.00 | 6.80 | K2 |
| 3 | 360 | 101 | 2.00 | 6.80 | K3 |
| ||
| x |
| 2 |
| 原料 | 理論值 | 實際值 | 利用率 |
| SO2 | 50.79 | 54.4 | 93.36% |
| NaCl | 92.86 | 101.0 | 91.94% |
| NH3 | 26.98 | 30.5 | 88.46% |
| 副產品NH4Cl | a | 87.1 | -------- |
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com