在一定條件下,二氧化硫和氧氣發生如下反應:2SO
2(g)+O
2(g)?2SO
3(g)△H<0
(1)寫出該反應的化學平衡常數表達式K=
.降低溫度,該反應K值
增大
增大
,二氧化硫轉化率
增大
增大
,V
正減小
減小
,V
逆減小
減小
.
(填“增大”“減小”或“不變”)
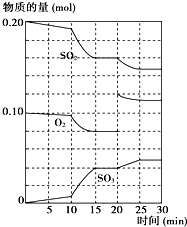
(2)600℃時,在一密閉容器中,將二氧化硫和氧氣混合,反應過程中SO
2、O
2、SO
3物質的量變化如圖所示,反應處于平衡狀態的時間是
15-20min、25-30min
15-20min、25-30min
.
(3)據右圖判斷,反應進行至20min時,曲線發生變化的原因是
增大氧氣的濃度
增大氧氣的濃度
(用文字表達);10min到15min的曲線變化的原因可能是
ab
ab
(填寫編號).
a.加了催化劑 b.縮小容器體積
c.降低溫度 d.增加SO
3的物質的量
(4)已知在600℃時,2SO
2(g)+O
2(g)?2SO
3(g)的平衡常數K=19,若600℃時測得容器內c(SO
2)=0.3mol/L,c(O
2)=0.1mol/L,c(SO
3)=0.4mol/L,在這種情況下,該反應是否處于平衡狀態?
否
否
(填“是”或“否”).此時,化學反應速率是v(正)
>
>
v(逆)(填“>”、“<”或“=”),原因是
反應向正方向進行
反應向正方向進行
.

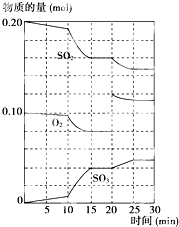 在一定條件下,二氧化硫和氧氣發生如下反應:2SO2(g)+O2(g)?2SO3(g)△H<0
在一定條件下,二氧化硫和氧氣發生如下反應:2SO2(g)+O2(g)?2SO3(g)△H<0 (1)化學平衡常數K表示可逆反應的進行程度,K值越大,表示
(1)化學平衡常數K表示可逆反應的進行程度,K值越大,表示 在一定條件下,二氧化硫和氧氣發生如下反應:2SO2(g)+O2 (g)?2SO3(g) (△H<0)
在一定條件下,二氧化硫和氧氣發生如下反應:2SO2(g)+O2 (g)?2SO3(g) (△H<0) 在一定條件下,二氧化硫和氧氣發生如下反應:2SO2(g)+O2(g)?2SO3(g)△H<0
在一定條件下,二氧化硫和氧氣發生如下反應:2SO2(g)+O2(g)?2SO3(g)△H<0 一定條件下,將SO2和O2充入一密閉容器中,發生如下反應:2SO2(g)+O2(g)
一定條件下,將SO2和O2充入一密閉容器中,發生如下反應:2SO2(g)+O2(g)