
題目列表(包括答案和解析)
汞(Hg)、鉻(Cr)是影響環境污染、生物效應和人類健康的重金屬元素。
I、鉻廣泛應用于鋼鐵工業、磁帶和錄像帶等方面。
(1)工業常采用“鋁在高溫條件下還原鉻綠(Cr2O3)”制備鉻單質,該反應的化學方程式為 。
II、含鉻的工業廢水會導致慢性中毒。處理含+6價鉻的廢水時可得到鐵氧體(其組成可寫作[Fe2+Fe3+(2-x) Cr3+x]O4)。

(2)加過量FeSO4的目的是 。
(3)配平步驟①的反應的離子方程式 Fe2++ Cr2O72—+ _____== Fe3++ Cr3++ H2O
并計算鐵氧體( [Fe2+Fe3+(2-x) Cr3+x]O4)中X= _________________。
(4)下表是實驗檢測中心對某地區二個點的土壤樣品(每個點分三層取樣,共6個樣品)進行了有機質和鉻總量的測定,結果見下表。
|
樣品序號 |
取樣深度(m) |
有機質(×10—2g) |
總鉻(×10—6g) |
|
樣品A-1 |
0.00 ~ 0.30 |
2.81 |
114 |
|
樣品A-2 |
0.30 ~ 0.60 |
1.72 |
111 |
|
樣品A-3 |
1.20 ~ 1.80 |
1.00 |
88 |
|
樣品B-1 |
0.00 ~ 0.30 |
2.60 |
116 |
|
樣品B-2 |
0.30 ~ 0.60 |
2.48 |
112 |
|
樣品B-3 |
1.20 ~ 1.80 |
1.83 |
106 |
從表中你可以得出的結論有 (答一點即可)。
(5)工業上以鉻酸鉀(K2CrO4)為原料,電化學法制備重鉻酸鉀,裝置如圖。反應為:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4鉻酸鉀溶液中存在平衡:2CrO42-(黃色)+2H+
2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4鉻酸鉀溶液中存在平衡:2CrO42-(黃色)+2H+ Cr2O72-(橙色)+H2O通電后陽極區溶液由 變為
。原因是
。
Cr2O72-(橙色)+H2O通電后陽極區溶液由 變為
。原因是
。


| 樣品序號 | 取樣深度(m) | 有機質(×10—2g) | 總鉻(×10—6g) |
| 樣品A-1 | 0.00 ~ 0.30 | 2.81 | 114 |
| 樣品A-2 | 0.30 ~ 0.60 | 1.72 | 111 |
| 樣品A-3 | 1.20 ~ 1.80 | 1.00 | 88 |
| 樣品B-1 | 0.00 ~ 0.30 | 2.60 | 116 |
| 樣品B-2 | 0.30 ~ 0.60 | 2.48 | 112 |
| 樣品B-3 | 1.20 ~ 1.80 | 1.83 | 106 |
 2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4鉻酸鉀溶液中存在平衡:2CrO42-(黃色)+2H+
2K2Cr2O7+4KOH+2H2↑+O2↑已知K2CrO4鉻酸鉀溶液中存在平衡:2CrO42-(黃色)+2H+ Cr2O72-(橙色)+H2O通電后陽極區溶液由 變為 。原因是 。
Cr2O72-(橙色)+H2O通電后陽極區溶液由 變為 。原因是 。
化學反應速率與化學平衡在日常生活、工農業生產和科學研究中具有重要的意義,在
化學實驗中涉及的電離平衡也屬于化學平衡。請回答下列問題:
(1)某研究性學習小組查閱資料發現金屬氧化物A也能催化氯酸鉀的分解,且A和二
氧化錳的最佳催化溫度均為500℃左右。于是對A和二氧化錳的催化性能進行了
定量對照實驗。實驗時均以收滿500 mL氧氣為準(其他可能影響實驗的因素均已
忽略)。
表一 用MnO2作催化劑
| 實驗序號 | KClO3質量/g | MnO2質量/g | 反應溫度/℃ | 待測數據 |
| 1 | 8.00 | 2.00 | 500 | |
| 2 | 8.00 | 2.00 | 500 |
表二 用A作催化劑
| 實驗序號 | KClO3質量/g | A的質量/g | 反應溫度/℃ | 待測數據 |
| 1 | 8.00 | 2.00 | 500 | |
| 2 | 8.00 | 2.00 | 500 |
請回答:上述實驗中的待測數據應是 。
完成此研究后,他們準備發表一篇研究報告,請你替他們擬一研究報告的標題:
。
(2)氨水是一種弱堿,某同學取0.1mo/L的氨水,用pH試紙測其pH,結果發現溶液的
pH約為11,以此得出氨水為弱堿的結論。該同學用pH試紙測定氨水pH的具體操
作是 。
(3)證明氨水是弱堿的常用方法還有兩種:一是設法證明NH![]() 的水解,一是設法使氨水
的水解,一是設法使氨水
電離平衡發生移動。
方法一:取少量NH4Cl晶體溶于水,滴入石蕊試液,溶液變紅,可見溶液顯酸性。
其原因是 。
方法二:取少量氨水,滴入酚酞變紅后再加入 ,振蕩,紅色變淺,c(OH—)下降,說明氨水的電離平衡向 移動。
(10分,每空2分)甲、乙兩個實驗小組利用KMnO4酸性溶液與H2C2O4溶液反應研究影響反應速率的因素。
(1)該反應的離子方程式為(提示:H2C2O4的一級電離平衡常數為5.4×10-2)
。
設計實驗方案如下(實驗中所用KMnO4溶液均已加入H2SO4):
(2)甲組:通過測定單位時間內生成CO2氣體體積的大小來比較化學反應速率的大小。 實驗裝置如圖,實驗時分液漏斗中A溶液一次性放下,A、B的成分見下表:
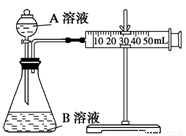
|
序號 |
A溶液 |
B溶液 |
|
① |
2 mL 0.1 mol/L H2C2O4溶液 |
4 mL 0.01 mol/L KMnO4溶液 |
|
② |
2 mL 0.2 mol/L H2C2O4溶液 |
4 mL 0.01 mol/L KMnO4溶液 |
|
③ |
2 mL 0.2 mol/L H2C2O4溶液 |
4 mL 0.01 mol/L KMnO4溶液和少量MnSO4 |
該實驗探究的是 對化學反應速率的影響。在反應停止之前,相同時間內針管中所得CO2的體積由大到小的順序是 (用實驗序號填空)。
(3)乙組:通過測定KMnO4溶液褪色所需時間的多少來比較化學反應速率的大小。
取兩支試管各加入2 mL 0.1 mol/L H2C2O4溶液,另取兩支試管各加入4 mL 0.1 mol/L KMnO4溶液。將四支試管分成兩組(各有一支盛有H2C2O4溶液和KMnO4溶液的試管),一組放入冷水中,另一組放入熱水中,經過一段時間后,分別混合并振蕩,記錄溶液褪色所需時間。該實驗目的是研究 對化學反應速率的影響,但該組同學始終沒有看到溶液褪色,其原因是 。
(10分,每空2分)甲、乙兩個實驗小組利用KMnO4酸性溶液與H2C2O4溶液反應研究影響反應速率的因素。
(1)該反應的離子方程式為(提示:H2C2O4的一級電離平衡常數為5.4×10-2)
。
設計實驗方案如下(實驗中所用KMnO4溶液均已加入H2SO4):
(2)甲組:通過測定單位時間內生成CO2氣體體積的大小來比較化學反應速率的大小。實驗裝置如圖,實驗時分液漏斗中A溶液一次性放下,A、B的成分見下表:
| 序號 | A溶液 | B溶液 |
| ① | 2 mL 0.1 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
| ② | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液 |
| ③ | 2 mL 0.2 mol/L H2C2O4溶液 | 4 mL 0.01 mol/L KMnO4溶液和少量MnSO4 |
該實驗探究的是 對化學反應速率的影響。在反應停止之前,相同時間內針管中所得CO2的體積由大到小的順序是 (用實驗序號填空)。
(3)乙組:通過測定KMnO4溶液褪色所需時間的多少來比較化學反應速率的大小。
取兩支試管各加入2 mL 0.1 mol/L H2C2O4溶液,另取兩支試管各加入4 mL 0.1 mol/L KMnO4溶液。將四支試管分成兩組(各有一支盛有H2C2O4溶液和KMnO4溶液的試管),一組放入冷水中,另一組放入熱水中,經過一段時間后,分別混合并振蕩,記錄溶液褪色所需時間。該實驗目的是研究 對化學反應速率的影響,但該組同學始終沒有看到溶液褪色,其原因是 。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com