
題目列表(包括答案和解析)
| c2(NH3) |
| c(N2)c3(H2) |
| c2(NH3) |
| c(N2)c3(H2) |
| 1 |
| 12 |
| 1 |
| 12 |
(12分)合成氨工業對國民經濟和社會發展具有重要的意義。其原理為:
N2(g)+3H2(g)  2NH3(g) △H=" -92.4KJ/mol " ,據此回答以下問題:
2NH3(g) △H=" -92.4KJ/mol " ,據此回答以下問題:
(1)下列有關該反應速率的敘述,正確的是(選填序號) 。
a.升高溫度可以增大活化分子百分數,加快反應速率
b.增大壓強不能增大活化分子百分數,所以不可以加快反應速率
c.使用催化劑可以使反應物分子平均能量升高,加快反應速率
d.在質量一定的情況下,催化劑顆粒的表面積大小,對反應速率有顯著影響
(2)①該反應的化學平衡常數表達式為K=_______________________。
②根據溫度對化學平衡的影響規律可知,對于該反應,溫度越高,其平衡常數的值越_____ 。
(3)某溫度下,若把10 mol N2與30 mol H2置于體積為10 L的密閉容器內,反應達到平衡狀態時,測得平衡混合氣體中氨的體積分數為20%,則該溫度下反應的K=___________(可用分數表示)。能說明該反應達到化學平衡狀態的是 (填字母)。
a.容器內的密度保持不變 b.容器內壓強保持不變
c.υ正(N2)=2υ逆(NH3) d.混合氣體中c(NH3)不變
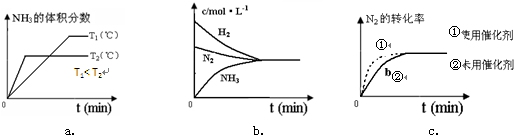
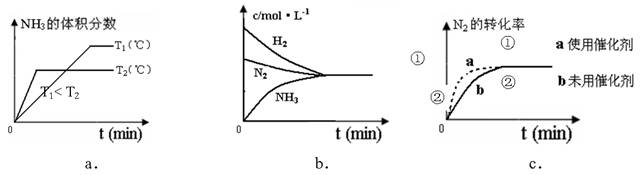
(4)對于合成氨反應而言,下列有關圖象一定正確的是(選填序號)_____________。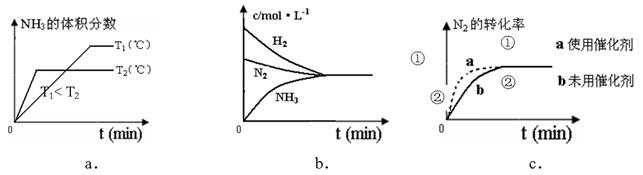
(5)相同溫度下,有恒容密閉容器A和恒壓密閉容器B,兩容器中均充入1mol N2和3 molH2,此時兩容器的體積相等。在一定條件下反應達到平衡狀態,A中NH3的體積分數為a,放出熱量Q1 kJ;
B中NH3的體積分數為b,放出熱量Q2 kJ。則:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
(12分)合成氨工業對國民經濟和社會發展具有重要的意義。其原理為:
N2(g)+3H2(g) 2NH3(g) △H= -92.4KJ/mol ,據此回答以下問題:
(1)下列有關該反應速率的敘述,正確的是(選填序號) 。
a.升高溫度可以增大活化分子百分數,加快反應速率
b.增大壓強不能增大活化分子百分數,所以不可以加快反應速率
c.使用催化劑可以使反應物分子平均能量升高,加快反應速率
d.在質量一定的情況下,催化劑顆粒的表面積大小,對反應速率有顯著影響
(2)①該反應的化學平衡常數表達式為K=_______________________。
②根據溫度對化學平衡的影響規律可知,對于該反應,溫度越高,其平衡常數的值越_____ 。
(3)某溫度下,若把10 mol N2與30 mol H2 置于體積為10 L的密閉容器內,反應達到平衡狀態時,測得平衡混合氣體中氨的體積分數為20%,則該溫度下反應的K=___________(可用分數表示)。能說明該反應達到化學平衡狀態的是 (填字母)。
a.容器內的密度保持不變 b.容器內壓強保持不變
c.υ正(N2)=2υ逆(NH3) d.混合氣體中 c(NH3)不變
(4)對于合成氨反應而言,下列有關圖象一定正確的是(選填序號)_____________。
(5)相同溫度下,有恒容密閉容器A和恒壓密閉容器B,兩容器中均充入1molN2和3 molH2,此時兩容器的體積相等。在一定條件下反應達到平衡狀態,A中NH3的體積分數為a,放出熱量Q1kJ;
B中NH3的體積分數為b,放出熱量Q2kJ。則:a_____b(填>、=、<), Q1_____Q2(填>、=、<), Q1_____92.4(填>、=、<)。
(12分)合成氨工業對國民經濟和社會發展具有重要的意義。其原理為:
N2(g)+3H2(g)  2NH3(g) △H= -92.4KJ/mol ,據此回答以下問題:
2NH3(g) △H= -92.4KJ/mol ,據此回答以下問題:
(1)下列有關該反應速率的敘述,正確的是(選填序號) 。
a.升高溫度可以增大活化分子百分數,加快反應速率
b.增大壓強不能增大活化分子百分數,所以不可以加快反應速率
c.使用催化劑可以使反應物分子平均能量升高,加快反應速率
d.在質量一定的情況下,催化劑顆粒的表面積大小,對反應速率有顯著影響
(2)①該反應的化學平衡常數表達式為K=_______________________。
②根據溫度對化學平衡的影響規律可知,對于該反應,溫度越高,其平衡常數的值越_____ 。
(3)某溫度下,若把10 mol N2與30 mol H2 置于體積為10 L的密閉容器內,反應達到平衡狀態時,測得平衡混合氣體中氨的體積分數為20%,則該溫度下反應的K=___________(可用分數表示)。能說明該反應達到化學平衡狀態的是 (填字母)。
a.容器內的密度保持不變 b.容器內壓強保持不變
c.υ正(N2)=2υ逆(NH3) d.混合氣體中 c(NH3)不變
(4)對于合成氨反應而言,下列有關圖象一定正確的是(選填序號)_____________。
(5)相同溫度下,有恒容密閉容器A和恒壓密閉容器B,兩容器中均充入1mol N2和3 molH2,此時兩容器的體積相等。在一定條件下反應達到平衡狀態,A中NH3的體積分數為a,放出熱量Q1 kJ;
B中NH3的體積分數為b,放出熱量Q2 kJ。則:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
[s1] 合成氨工業對國民經濟和社會發展具有重要的意義。其原理為:
N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4KJ/mol ,據此回答以下問題:
2NH3(g) △H=-92.4KJ/mol ,據此回答以下問題:
(1)下列有關該反應速率的敘述,正確的是(選填序號) 。
a.升高溫度可以增大活化分子百分數,加快反應速率
b.增大壓強不能增大活化分子百分數,所以不可以加快反應速率
c.使用催化劑可以使反應物分子平均能量升高,加快反應速率
d.在質量一定的情況下,催化劑顆粒的表面積大小,對反應速率有顯著影響
(2)①該反應的化學平衡常數表達式為K=_______________________。
②根據溫度對化學平衡的影響規律可知,對于該反應,溫度越高,其平衡常數的值越_____ 。
(3)某溫度下,若把10 mol N2與30 mol H2 置于體積為10 L的密閉容器內,反應達到平衡狀態時,測得平衡混合氣體中氨的體積分數為20%,則該溫度下反應的K=___________(可用分數表示)。能說明該反應達到化學平衡狀態的是 (填字母)。
a.容器內的密度保持不變 b.容器內壓強保持不變
c.υ正(N2)=2υ逆(NH3) d.混合氣體中 c(NH3)不變
(4)對于合成氨反應而言,下列有關圖象一定正確的是(選填序號)_____________。
|
|
|
|
|



a. b. c.
(5)相同溫度下,有恒容密閉容器A和恒壓密閉容器B,兩容器中均充入1molN2和3 molH2,此時兩容器的體積相等。在一定條件下反應達到平衡狀態,A中NH3的體積分數為a,放出熱量Q1 kJ;
B中NH3的體積分數為b,放出熱量Q2 kJ。則:
a_____b(填>、=、<), Q1_____Q2(填>、=、<), Q1_____92.4(填>、=、<)。
[s1]24.
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com