
題目列表(包括答案和解析)
反應aA(g)+bB(g) ![]() cC(g)(ΔH<0)在等容條件下進行。改變其他反應條件,在Ⅰ、Ⅱ、Ⅲ階段體系中各物質濃度隨時間變化的曲線如下圖所示:
cC(g)(ΔH<0)在等容條件下進行。改變其他反應條件,在Ⅰ、Ⅱ、Ⅲ階段體系中各物質濃度隨時間變化的曲線如下圖所示:
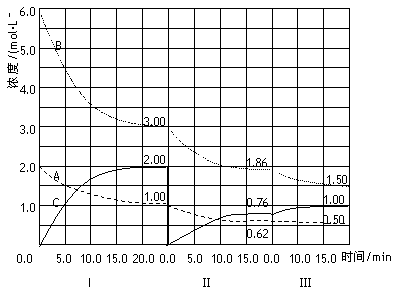
回答問題:
(1)反應的化學方程式中,a:b:c為_____________;
(2)A的平均反應速率vI(A)、vⅡ(A)、vⅢ(A)從大到小排列次序為_________;
(3)B的平衡轉化率αI(B)、αⅡ(B)、αⅢ(B)中最小的是_____,其值是__________;
(4)由第一次平衡到第二次平衡,平衡移動的方向是________________,采取的措施是____________;
(5)比較第Ⅱ階段反應溫度(T2)和第Ⅲ階段反應溫度(T3)的高低:T2 T3(填“>”“<”“=”)。
反應aA(g)+bB(g) ![]() cC(g)(ΔH<0)在等容條件下進行。改變其它反應條件,在Ⅰ、Ⅱ、Ⅲ階段體系中各物質濃度隨時間變化的曲線如下圖所示:
cC(g)(ΔH<0)在等容條件下進行。改變其它反應條件,在Ⅰ、Ⅱ、Ⅲ階段體系中各物質濃度隨時間變化的曲線如下圖所示:

回答下列問題:
(1) 反應的化學方程式中,a:b:c為_____________;
(2) A的平均反應速率vI (A)、vⅡ (A)、vⅢ (A)從大到小排列次序為_________;
(3) 由第一次平衡到第二次平衡,平衡移動的方向是_________,采取的措施是________;
(4) 比較第Ⅱ階段反應溫度(T2)和第Ⅲ階段反應溫度(T3)的高低:T2 T3(填“>”“<”“=”),判斷的理由是_________________________________________; Ks5u
 cC( g) (△H<0) 在等容條件下進行。改變其他反應條件,在 I、Ⅱ、Ⅲ階段,體系中各物質濃度隨時間變化的曲線如圖所示。下列推斷合理的是
cC( g) (△H<0) 在等容條件下進行。改變其他反應條件,在 I、Ⅱ、Ⅲ階段,體系中各物質濃度隨時間變化的曲線如圖所示。下列推斷合理的是 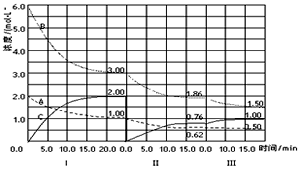
aA(g)+bB(g)![]() cC(g)+dD(g)反應達到平衡時,瞬時速率
cC(g)+dD(g)反應達到平衡時,瞬時速率![]() 為速率常數),又
為速率常數),又![]() 為化學平衡常數).在2L體系中加入4 mol SO2和2 mol O2且500℃進行反應并保持溫度不變,反應達平衡時,SO2轉化率為50%,則:
為化學平衡常數).在2L體系中加入4 mol SO2和2 mol O2且500℃進行反應并保持溫度不變,反應達平衡時,SO2轉化率為50%,則:
(1)起始時正反應速率是平衡時的_________倍.
(2)在500℃時該反應的平衡常數k2是_________.
(3)在溫度不變時再向平衡體系中加入2 mol SO2、2 mol O2和4 mol SO3,平衡將向_________移動.
反應aA(g)+bB(g) ![]() cC(g)(ΔH<0)在等容條件下進行。改變其他反應條件,在Ⅰ、Ⅱ、Ⅲ階段體系中各物質濃度隨時間變化的曲線如下圖所示:
cC(g)(ΔH<0)在等容條件下進行。改變其他反應條件,在Ⅰ、Ⅱ、Ⅲ階段體系中各物質濃度隨時間變化的曲線如下圖所示:

回答問題:
(1)反應的化學方程式中,a∶b∶c為________。
(2)A的平均反應速率vⅠ(A)、vⅡ(A)、vⅢ(A)從大到小排列次序為________。
(3)由第一次平衡到第二次平衡,平衡移動的方向是____________,采取的措施是__________________________。
(4)比較第Ⅱ階段反應溫度(T2)和第Ⅲ階段反應溫度(T3)的高低: T2________T3(填“>”、“=”、“<”),判斷的理由是__________________________。
(5)達到第三次平衡后,將容器的體積擴大一倍,假定10min后達到新的平衡,請在下圖中用曲線表示第Ⅳ階段體系中各物質的濃度隨時間變化的趨勢(曲線上必須標出A、B、C)。

湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com