
題目列表(包括答案和解析)
(1)常溫下,高錳酸鉀晶體遇濃鹽酸會生成一種氣體,該氣體是由瑞典化學家舍勒首先發現的。如圖所示,將濃鹽酸小心滴入Y形管B端。
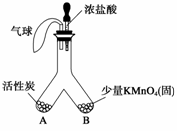
①開始觀察到的現象是 。
②一段時間后又可觀察到 ,請解釋這一現象 。
③應用活性炭的此性質可制作 來達到防毒、防臭的目的(舉一例即可)。
(2)①寫出CO2和Na2O2反應的化學方程式 。
②某學生判斷SO2和Na2O2反應能生成硫酸鈉,你認為他的判斷合理嗎? 。
簡要說明理由: 。
③該同學無法斷定反應中是否有氧氣生成,擬使用如圖所示裝置進行實驗(圖中鐵架臺等裝置已略去)。
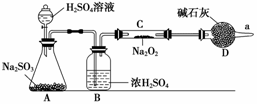
裝置中B的作用是 ,
D的作用是 。
④如何證明該同學的兩個推斷?
。
某實驗小組分別用圖1、2裝置測定某種鈣片中碳酸鈣的含量,夾持裝置已略去。
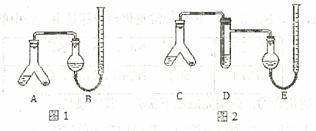
提供的試劑:研細的鈣片粉末 (鈣片中的其他成分不與鹽酸反應)、![]() 鹽酸、5%NaOH溶液、飽和
鹽酸、5%NaOH溶液、飽和![]() 溶液、飽和
溶液、飽和![]() 溶液和蒸餾水。
溶液和蒸餾水。
實驗過程:
Ⅰ.檢查兩套裝置的氣密性。
Ⅱ.在A、C的右邊加入0.25g鈣片粉末,左邊加入3mL![]() 鹽酸,塞緊塞子。在B、E中均加入飽和
鹽酸,塞緊塞子。在B、E中均加入飽和![]() 溶液,如圖所示,記下量氣管讀數。
溶液,如圖所示,記下量氣管讀數。
Ⅲ.將A、C傾斜,使液體與固體混合,實驗結束并冷卻后讀出量氣管讀數,測得B中收集到的氣體為41.90mL,E中收集到的氣體體積為39.20mL(以上氣體體積均已折算為標準狀況下的體積)。
回答下列問題:
(1)Ⅰ中檢查圖1裝置氣密性的萬法是
。
(2)A中發生反應的離子方程式為 ;
D中加入試劑為 ,D的作用是 。
(3)實驗前左右兩管液面在同一水平面上,最后讀數時右管的液面高于左管的液面,應進行的操作是
。
(4)圖2實驗所得鈣片中的碳酸鈣的質量分數為 ;圖1實驗比圖 2實驗所得鈣片中的碳酸鈣含量偏高,用離子萬程式表示偏高的原因
。

隨著人類對溫室效應和資源短缺等問題的重視,如何降低大氣中CO2的含量及有效地開發利用CO2,引起了各國的普遍重視。
(1)目前,用超臨界CO2(其狀態介于氣態和液態之間)代替氟利昂作冷劑已成為一種趨勢,這一做法對環境的積極意義在于 。
(2)將CO2轉化成有機物可有效實現碳循環。CO2轉化成有機物的例子很多,如:
a.6CO2+6H2O  C6H12O6+6O2 b .CO2+3H2?
C6H12O6+6O2 b .CO2+3H2?  CH3OH+H2O
CH3OH+H2O
c.CO2+CH4  CH3COOH d. 2CO2+6H2
CH3COOH d. 2CO2+6H2  CH2==CH2+4H2O
CH2==CH2+4H2O
以上反應中,最節能的是 ,原子利用率最高的是 。
(3)為探究用CO2來生產燃料甲醇的反應原理,現進行如下實驗:
在體積為1L的密閉容器中,充入1molCO2和3molH2,一定條件下發生反應:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
|
①從反應開始到平衡,氫氣的平均反應速率v(H2)= mol/(L·min)
②該反應的平衡常數表達式為 ,升高溫度,平衡常數的數值將
(填“增大”、“減小”或“不變”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是 .
A.升高溫度 B.充入He(g),使體系壓強增大
C.將H2O(g)從體系中分離 D.再充入1molCO2和3molH2
(4)氫氣是合成氨的重要原料,合成氨反應的熱化學方程式如下:
N2(g)+3H2(g) ![]() 2NH3(g) △H=-93.4kJ/mol
2NH3(g) △H=-93.4kJ/mol
①當合成氨反應達到平衡后,改變某一外界條件(不改變N2、H2和NH3的量),反應速率與時間的關系如下圖所示。
|
圖t1時引起平衡移動的條件可能是 。
其中表示平衡混合物中NH3含量最高的一段時間是 。
②溫度為T°C時,將3amolH2和amolN2放入帶有活塞的密閉容器中,如果活塞能自由移動,充分反應后測得N2的轉化率為50%。如果在相同溫度下將3amolH2、amolN2和2amolNH3氣體放入該容器中,平衡時H2的轉化率為 。
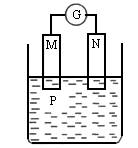
項目 M N P
A 鋅 銅 稀硫酸溶液
B 銅 鐵 稀鹽酸
C 銀 鋅 硝酸銀溶液
D 鋅 鐵 硝酸鐵溶液
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com