
題目列表(包括答案和解析)
(12分)能源短缺是人類社會面臨的重大問題。甲醇是一種可再生能源,具有廣泛的開發和應用前景。工業上合成甲醇的反應為:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH
(1)已知,該反應在300℃,5MPa條件下能自發進行,則ΔH 0,△S 0 (填“<,>或=”)。
(2)在300℃,5MPa條件下,將0.20mol的 CO與0.58mol H2的混合氣體充入2L密閉容器發生反應,反應過程中甲醇的物質的量濃度隨時間的變化如圖所示。

①在0~2min內,以H2表示的平均反應速率為 mol·L-1·s-1 。
②列式計算300℃時該反應的平衡常數K = 。
③300℃時,將0.50mol CO、1.00mol H2和1.00 mol CH3OH充入容積為2L的密閉容器中,此時反應將 。
A.向正方向移動 B.向逆方向移動 C.處于平衡狀態 D.無法判斷
④下列措施可增加甲醇產率的是
A.壓縮容器體積 B.將CH3OH(g)從體系中分離
C.充入He,使體系總壓強增大 D.再充入0.20mol CO和0.58mol H2
(3)若其它條件不變,使反應在500℃下進行,在圖中作出甲醇的物質的量濃度隨時間的變化的示意圖。
【解析】(1)根據反應的特點可知△S小于0,因為反應在300℃,5MPa條件下能自發進行,所以根據△G=△H-T·△S可知反應是放熱反應。
(2)①反應速率通常用單位時間內濃度的變化量來表示,根據圖像可知反應進行到2min時甲醇
的濃度不再發生變化,平衡時甲醇的物質的量是0.04mol,則消耗氫氣是0.08mol,所以在0~2min
內,以H2表示的平均反應速率為 。
。
②平衡時氫氣的濃度是 ,CO的平衡濃度是
,CO的平衡濃度是
 ,所以該溫度下的平衡常數為
,所以該溫度下的平衡常數為 。
。
③300℃時,將0.50mol CO、1.00mol H2和1.00 mol
CH3OH充入容積為2L的密閉容器中,此時它們的濃度分別為0.25mol/L、0.50mol/L、、0.50mol/L,因為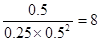 >4,所以反應向逆反應方向移動。
>4,所以反應向逆反應方向移動。
④壓縮體積,壓強增大,平衡向正反應方向移動。選項B是降低生成物濃度,平衡也向正反應方
向移動。充入He,使體系總壓強增大,但物質但濃度沒有變化,所以平衡不移動。再充入0.20mol
CO和0.58mol H2,相當于增大體系的壓強,平衡向正反應方向移動,所以答案是ABD。
(3)因為反應是放熱反應,所以升高溫度平衡向逆反應方向移動,但反應速率會加快,所以圖
像為

 4C(g) △H >0 達到平衡時,c(A)=2mol/L,c(B)=7mol/L,c(C)=4mol/L。試確定B的起始濃度c(B)的取值范圍是____________若改變條件重新達到平衡后體系中C的質量分數增大,下列措施可行的是_____________
4C(g) △H >0 達到平衡時,c(A)=2mol/L,c(B)=7mol/L,c(C)=4mol/L。試確定B的起始濃度c(B)的取值范圍是____________若改變條件重新達到平衡后體系中C的質量分數增大,下列措施可行的是_____________ 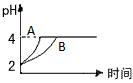
(20分)選修四模塊的平衡理論主要包括:化學平衡、電離平衡、水解平衡和溶解平衡四種,且均符合勒夏特列原理。請回答下列問題:
(1) 一定溫度下,在一個固定容積的密閉容器中,可逆反應 A(g) +2B(g)  4C (g) △H >0 達到平衡時,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。試確定B的起始濃度c (B)的取值范圍是 ;若改變條件重新達到平衡后體系中C的質量分數增大,下列措施可行的是 。
4C (g) △H >0 達到平衡時,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。試確定B的起始濃度c (B)的取值范圍是 ;若改變條件重新達到平衡后體系中C的質量分數增大,下列措施可行的是 。
A. 增加C的物質的量 B. 加壓
C. 升溫 D.使用催化劑
(2)常溫下,取 pH=2的鹽酸和醋酸溶液各100mL, 向其中分別加入適量的Zn粒,反應過程中兩溶液的pH變化如右圖所示。則圖中表示醋酸溶液中pH變化曲線的是 ( 填“A”或“B”)。 設鹽酸中加入的Zn質量為m1,醋酸溶液中加入的Zn質量為 m2。 則
m1 m2 ( 選填“<”、“=”、“>”)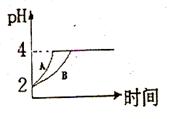
(3) 在體積為3L的密閉容器中,CO與H2在一定條件下反應生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) ΔH= —91kJ·mol-1。反應達到平衡時,平衡常數表達式K= ,升高溫度,K值 (填“增大”、“減小”或“不變”)。
(4) 難溶電解質在水溶液中也存在溶解平衡。在常溫下,溶液里各離子濃度以它們化學計量數為方次的乘積是一個常數,叫溶度積常數。例如: Cu(OH)2(s) Cu2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu2+ ) c 2(OH - ) =" 2×10" -20。當溶液中各離子濃度計量數方次的乘積大于溶度積時,則產生沉淀。若某CuSO4溶液里c( Cu2+) ="0.02" mol·L-1,如果生成Cu(OH)2沉淀,應調整溶液pH,使pH大于 ; 要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀較為完全 ( 使Cu2+濃度降至原來的萬分之一)則應向溶液里加NaOH溶液,使溶液pH等于 。
Cu2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu2+ ) c 2(OH - ) =" 2×10" -20。當溶液中各離子濃度計量數方次的乘積大于溶度積時,則產生沉淀。若某CuSO4溶液里c( Cu2+) ="0.02" mol·L-1,如果生成Cu(OH)2沉淀,應調整溶液pH,使pH大于 ; 要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀較為完全 ( 使Cu2+濃度降至原來的萬分之一)則應向溶液里加NaOH溶液,使溶液pH等于 。
(5) 常溫下,某純堿(Na2CO3) 溶液中滴入酚酞,溶液呈紅色。則該溶液呈 性。在分析該溶液遇酚酞呈紅色原因時,甲同學認為是配制溶液所用的純堿樣品中混有NaOH 所致;乙同學認為是溶液中Na2CO3電離出的CO32-水解所致。請你設計一個簡單的實驗方案用來評判甲乙兩位同學的觀點是否正確(包括操作、現象和結論) 。
(20分)選修四模塊的平衡理論主要包括:化學平衡、電離平衡、水解平衡和溶解平衡四種,且均符合勒夏特列原理。請回答下列問題:
(1) 一定溫度下,在一個固定容積的密閉容器中,可逆反應
A(g) +2B(g)  4C (g) △H >0 達到平衡時,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。試確定B的起始濃度c (B)的取值范圍是 ;若改變條件重新達到平衡后體系中C的質量分數增大,下列措施可行的是 。
4C (g) △H >0 達到平衡時,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。試確定B的起始濃度c (B)的取值范圍是 ;若改變條件重新達到平衡后體系中C的質量分數增大,下列措施可行的是 。
A. 增加C的物質的量 B. 加壓
C. 升溫 D.使用催化劑
(2)常溫下,取 pH=2的鹽酸和醋酸溶液各100mL, 向其中分別加入適量的Zn粒,反應過程中兩溶液的pH變化如右圖所示。則圖中表示醋酸溶液中pH變化曲線的是 ( 填“A”或“B”)。 設鹽酸中加入的Zn質量為m1,醋酸溶液中加入的Zn質量為 m2。 則
m1 m2 ( 選填“<”、“=”、“>”)

(3) 在體積為3L的密閉容器中,CO與H2在一定條件下反應生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) ΔH= —91kJ·mol-1。反應達到平衡時,平衡常數表達式K= ,升高溫度,K值 (填“增大”、“減小”或“不變”)。
(4) 難溶電解質在水溶液中也存在溶解平衡。在常溫下,溶液里各離子濃度以它們化學計量數為方次的乘積是一個常數,叫溶度積常數。例如: Cu(OH)2(s) Cu2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu2+ ) c 2(OH
- ) =" 2×10" -20。當溶液中各離子濃度計量數方次的乘積大于溶度積時,則產生沉淀。若某CuSO4溶液里c( Cu2+) ="0.02" mol·L-1,如果生成Cu(OH)2沉淀,應調整溶液pH,使pH大于 ;
要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀較為完全 ( 使Cu2+濃度降至原來的萬分之一)則應向溶液里加NaOH溶液,使溶液pH等于 。
Cu2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu2+ ) c 2(OH
- ) =" 2×10" -20。當溶液中各離子濃度計量數方次的乘積大于溶度積時,則產生沉淀。若某CuSO4溶液里c( Cu2+) ="0.02" mol·L-1,如果生成Cu(OH)2沉淀,應調整溶液pH,使pH大于 ;
要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀較為完全 ( 使Cu2+濃度降至原來的萬分之一)則應向溶液里加NaOH溶液,使溶液pH等于 。
(5) 常溫下,某純堿(Na2CO3) 溶液中滴入酚酞,溶液呈紅色。則該溶液呈 性。在分析該溶液遇酚酞呈紅色原因時,甲同學認為是配制溶液所用的純堿樣品中混有NaOH 所致;乙同學認為是溶液中Na2CO3電離出的CO32-水解所致。請你設計一個簡單的實驗方案用來評判甲乙兩位同學的觀點是否正確(包括操作、現象和結論) 。
選修四模塊的平衡理論主要包括:化學平衡、電離平衡、水解平衡和溶解平衡四種,且均符合勒夏特列原理。請回答下列問題:
(1) 一定溫度下,在一個固定容積的密閉容器中,可逆反應 A(g) +2B(g) ![]() 4C (g) △H >0 達到平衡時,c(A) =2 mol·L-1,c ( B) = 7 mol·L-1,c ( C) = 4 mol·L-1。試確定B的起始濃度c (B)的取值范圍是 ;若改變條件重新達到平衡后體系中C的質量分數增大,下列措施可行的是 。
4C (g) △H >0 達到平衡時,c(A) =2 mol·L-1,c ( B) = 7 mol·L-1,c ( C) = 4 mol·L-1。試確定B的起始濃度c (B)的取值范圍是 ;若改變條件重新達到平衡后體系中C的質量分數增大,下列措施可行的是 。
 A. 增加C的物質的量 B. 加壓
A. 增加C的物質的量 B. 加壓
C. 升溫 D. 使用催化劑
(1)常溫下,取 pH=2的鹽酸和醋酸溶液各100mL, 向其中分別加入適量的Zn粒,反應過程中兩溶液的pH變化如右圖所示。則圖中表示醋酸溶液中pH變化曲線的是 ( 填“A”或“B”)。 設鹽酸中加入的Zn質量為m1,醋酸溶液中加入的Zn質量為 m2。 則
m1 m2 ( 選填“<”、“=”、“>”)
(3) 在體積為3L的密閉容器中,CO與H2在一定條件下反應生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) ΔH= —91kJ·mol-1。反應達到平衡時,平衡常數表達式K= ,升高溫度,K值 (填“增大”、“減小”或“不變”)。
(4) 難溶電解質在水溶液中也存在溶解平衡。在常溫下,溶液里各離子濃度以它們化學計量數為方次的乘積是一個常數,叫溶度積常數。例如: Cu(OH)2(s)![]() Cu2+ (aq) + 2OH - ( aq),Ksp = c (Cu2+ ) c 2(OH - ) = 2×10 -20。當溶液中各離子濃度計量數方次的乘積大于溶度積時,則產生沉淀。若某CuSO4溶液里c( Cu2+) =0.02 mol·L-1,如果生成Cu(OH)2沉淀,應調整溶液pH,使pH大于 ; 要使0.2 mol·L-1的CuSO4 溶液中Cu2+沉淀較為完全 ( 使Cu2+濃度降至原來的萬分之一)則應向溶液里加NaOH溶液,使溶液pH等于 。
Cu2+ (aq) + 2OH - ( aq),Ksp = c (Cu2+ ) c 2(OH - ) = 2×10 -20。當溶液中各離子濃度計量數方次的乘積大于溶度積時,則產生沉淀。若某CuSO4溶液里c( Cu2+) =0.02 mol·L-1,如果生成Cu(OH)2沉淀,應調整溶液pH,使pH大于 ; 要使0.2 mol·L-1的CuSO4 溶液中Cu2+沉淀較為完全 ( 使Cu2+濃度降至原來的萬分之一)則應向溶液里加NaOH溶液,使溶液pH等于 。
(5) 常溫下,某純堿(Na2CO3) 溶液中滴入酚酞,溶液呈紅色。則該溶液呈 性。在分析該溶液遇酚酞呈紅色原因時,甲同學認為是配制溶液所用的純堿樣品中混有NaOH 所致;乙同學認為是溶液中Na2CO3電離出的CO32-水解所致。請你設計一個簡單的實驗方案用來評判甲乙兩位同學的觀點是否正確(包括操作、現象和結論) 。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com