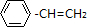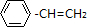I.已知:

,如果要合成
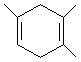
,所用的原料可以是
AD
AD
A.2-甲基-l,3-丁二烯和2-丁炔 B.1,3-戊二烯和2-丁炔
C.2,3-二甲基-1,3-戊二烯和乙炔 D.2,3-二甲基-l,3-丁二烯和丙炔
II.(1)由于苯的含碳量與乙炔相同,人們認為它是一種不飽和烴,寫出C
6H
6的一種含叁鍵且無雙鍵、無支鏈的鏈烴的結構簡式
HC≡C-C≡C-CH2-CH3
HC≡C-C≡C-CH2-CH3
;
(2)苯不能使溴水褪色,性質類似烷烴,寫出苯的硝化反應的化學方程式
;
(3)1866年凱庫勒(如圖)提出了苯的單、雙鍵交替的正六邊形平面結構,解釋了苯的部分性質,但還有一些問題尚未解決,它不能解釋下列事實(填入編號)
ad
ad
a.苯不能使溴水褪色 b.苯能與H
2發生加成反應 c.溴苯沒有同分異構體 d.鄰二溴苯只有一種
(4)苯分子的空間構型為
平面正六邊形
平面正六邊形
;現代化學認為苯分子碳碳之間的鍵是
介于單鍵和雙鍵之間的獨特的鍵
介于單鍵和雙鍵之間的獨特的鍵
.
Ⅲ.0.1mol某烴完全燃燒生成0.4mol H
2O,又知其含碳量為92.307%,則此有機物的分子式為
C8H8
C8H8
.若它是能聚合成高分子化合物的芳香族化合物,其結構簡式為
;若其不能與氫氣發生加成反應,且每個碳原子與另外三個碳原子相連接,鍵角為90度,則其結構式為
(用鍵線式表示),它的一氯代物有
1
1
種,二氯代物有
3
3
種.

 (2008?南京二模)(1)土壤的pH一般在4~9之間.土壤中Na2CO3含量較高時,pH可以高達10.5,
(2008?南京二模)(1)土壤的pH一般在4~9之間.土壤中Na2CO3含量較高時,pH可以高達10.5, HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O H2CO3+OH-
H2CO3+OH- HCO3-+OH-、HCO3-+H2O
HCO3-+OH-、HCO3-+H2O H2CO3+OH-
H2CO3+OH-
 【物質結構與性質】
【物質結構與性質】 某實驗小組為確定過氧化氫分解的最佳催化條件,用如圖實驗裝置進行實驗,反應物用量和反應停止的時間數據如下:
某實驗小組為確定過氧化氫分解的最佳催化條件,用如圖實驗裝置進行實驗,反應物用量和反應停止的時間數據如下: I.已知:
I.已知: ,如果要合成
,如果要合成 ,所用的原料可以是
,所用的原料可以是