
題目列表(包括答案和解析)


| 除雜試劑 | 方法 | |
| C2H6 (C2H2) | ||
| C6H6(C6H5OH) |
《化學與技術》
20-1.(6分,該題為多項選擇題,全選對得6分,漏選按比例給分,錯選或多選為0分)下列有關工業生產的敘述正確的是 ( )
A.合成氨生產過程中將NH3液化分離,可以提高N2、H2轉化率
B.硫酸工業中,在接觸室安裝熱交換器是為了利用SO3轉化為H2SO4時放出的熱量
C.電解飽和食鹽水制燒堿采用離子交換膜法,可防止陰極室產生的Cl2進入陽極室
D.電解精煉銅時,同一時間內陽極溶解銅的質量比陰極析出銅的質量小
E.煉鐵過程中碳被氧化,既起產生熱量的作用,又起產生CO的作用
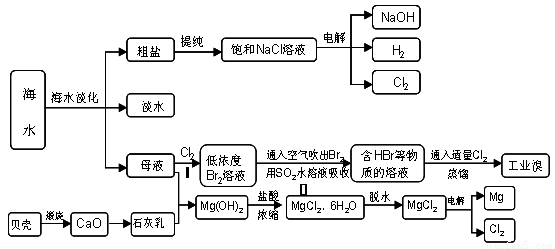
20-2.(14分)海南省是海洋大省,海水是人類寶貴的自然資源,從海水中可以提取多種化工原料,下圖是某工廠對海水資源綜合利用的示意圖:
(1)請列舉海水淡化的兩種方法 、 。
(2)步驟Ⅰ中已獲得Br2,步驟Ⅱ中又將Br2還原為Br -,其目的是: 。
步驟Ⅱ用SO2水溶液吸收Br2,吸收率可達95%,有關反應的離子方程式
(3)在制取無水氯化鎂時需要在干躁的HCl氣流中加熱MgCl2.6H2O的原因
(4)電解無水氯化鎂所得的鎂蒸氣在特定的環境里冷卻后即為固體鎂,下列物質中可以
用做鎂蒸氣的冷卻劑的是( )
A.H2 B.CO2
C.空氣 D.O2 E.水蒸氣
(5)從各種經營綜合開發,打造大而強的現代企業以及本廠生產所需要的原料等方面來
看,你認為該化工廠還可以再增加的生產項目的 。
《化學與技術》
20-1.(6分,該題為多項選擇題,全選對得6分,漏選按比例給分,錯選或多選為0分)下列有關工業生產的敘述正確的是 ( )
A.合成氨生產過程中將NH3液化分離,可以提高N2、H2轉化率
B.硫酸工業中,在接觸室安裝熱交換器是為了利用SO3轉化為H2SO4時放出的熱量
C.電解飽和食鹽水制燒堿采用離子交換膜法,可防止陰極室產生的Cl2進入陽極室
D.電解精煉銅時,同一時間內陽極溶解銅的質量比陰極析出銅的質量小
E.煉鐵過程中碳被氧化,既起產生熱量的作用,又起產生CO的作用
20-2.(14分)海南省是海洋大省,海水是人類寶貴的自然資源,從海水中可以提取多種化工原料,下圖是某工廠對海水資源綜合利用的示意圖:
(1)請列舉海水淡化的兩種方法 、 。
(2)步驟Ⅰ中已獲得Br2,步驟Ⅱ中又將Br2還原為Br -,其目的是: 。
步驟Ⅱ用SO2水溶液吸收Br2,吸收率可達95%,有關反應的離子方程式
(3)在制取無水氯化鎂時需要在干躁的HCl氣流中加熱MgCl2.6H2O的原因
(4)電解無水氯化鎂所得的鎂蒸氣在特定的環境里冷卻后即為固體鎂,下列物質中可以
用做鎂蒸氣的冷卻劑的是( )
A.H2 B.CO2
C.空氣 D.O2 E.水蒸氣
(5)從各種經營綜合開發,打造大而強的現代企業以及本廠生產所需要的原料等方面來
看,你認為該化工廠還可以再增加的生產項目的 。
《化學與技術》
20-1.(6分,該題為多項選擇題,全選對得6分,漏選按比例給分,錯選或多選為0分)下列有關工業生產的敘述正確的是 ( )
A.合成氨生產過程中將NH3液化分離,可以提高N2、H2轉化率
B.硫酸工業中,在接觸室安裝熱交換器是為了利用SO3轉化為H2SO4時放出的熱量
C.電解飽和食鹽水制燒堿采用離子交換膜法,可防止陰極室產生的Cl2進入陽極室
D.電解精煉銅時,同一時間內陽極溶解銅的質量比陰極析出銅的質量小
E.煉鐵過程中碳被氧化,既起產生熱量的作用,又起產生CO的作用
20-2.(14分)海南省是海洋大省,海水是人類寶貴的自然資源,從海水中可以提取多種化工原料,下圖是某工廠對海水資源綜合利用的示意圖:
(1)請列舉海水淡化的兩種方法 、 。
(2)步驟Ⅰ中已獲得Br2,步驟Ⅱ中又將Br2還原為Br -,其目的是: 。
步驟Ⅱ用SO2水溶液吸收Br2,吸收率可達95%,有關反應的離子方程式
(3)在制取無水氯化鎂時需要在干躁的HCl氣流中加熱MgCl2.6H2O的原因
(4)電解無水氯化鎂所得的鎂蒸氣在特定的環境里冷卻后即為固體鎂,下列物質中可以
用做鎂蒸氣的冷卻劑的是( )
A.H2 B.CO2
C.空氣 D.O2 E.水蒸氣
(5)從各種經營綜合開發,打造大而強的現代企業以及本廠生產所需要的原料等方面來
看,你認為該化工廠還可以再增加的生產項目的 。
(6分)下列說法正確的是 (填序號)。
①由于碘在酒精中的溶解度大,所以可用酒精將碘水中的碘萃取出來
②水的沸點是100℃,酒精的沸點是78.5℃,用直接蒸餾法能使含水酒精變為無水酒精
③由于膠粒的直徑比離子大,所以淀粉溶液中混有的碘化鉀可用滲析法分離
④分離苯和苯酚的混合液,先加入適量濃溴水,再過濾、分液,即可實現
⑤由于高級脂肪酸鈉鹽在水中的分散質微粒直徑在1nm~100 nm之間,所以可用食鹽使高級脂肪酸納從皂化反應后的混合物中析出
⑥不慎把苯酚溶液沾到皮膚上,應立即用酒精洗滌
⑦用稀溴水滴入苯酚溶液中制備2,4,6-三溴苯酚
⑧實驗室使用體積比為1:3的濃硫酸與乙醇的混合溶液制乙烯時,為防加熱時反應混合液出現暴沸現象,除了要加沸石外,還應注意緩慢加熱讓溫度慢慢升至170℃
17..(18分)某化學小組采用類似制乙酸乙酯的裝置(如右圖),以環己醇制備環己烯:
 已知:
已知:
| 密度 | 熔點 | 沸點 | 溶解性 | |
| 環己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 環己烯 | 0.81 | -103 | 83 | 難溶于水 |
(1)制備粗品
將12.5mL環己醇加入試管A中,再加入1mL濃硫酸,搖勻后放入碎瓷片,緩慢加熱至反應完全,在試管C內得到環己烯粗品。
①A中碎瓷片的作用是 ,
導管B除了導氣外還具有的作用是 。
②試管C置于冰水浴中的目的是 。
 (2)制備精品
(2)制備精品
①環己烯粗品中含有環己醇和少量酸性雜質等。加入飽和
食鹽水,振蕩、靜置、分層,環己烯在 層(填
“上”或“下”),分液后用 (填入編號)洗滌。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②再將環己烯按右圖裝置蒸餾,冷卻水從 口進入。
蒸餾時要加入生石灰,目的是: 。
③收集產品時,控制的溫度應在 左右,實驗制得的環己烯精品質量低于理論產量,可能的原因是 ( )
A.蒸餾時從70℃開始收集產品 B.環己醇實際用量多了
C.制備粗品時環己醇隨產品一起蒸出
(3)以下區分環己烯精品和粗品的方法,合理的是 ( )
A.用酸性高錳酸鉀溶液 B.用金屬鈉 C.測定沸點
18.(12分)有機
物A的結構簡式為![]() ,它可通過不同化學反應分別制得B、C、D和E四種物質。
,它可通過不同化學反應分別制得B、C、D和E四種物質。

請回答下列問題:
(1)指出反應的類型:A→C: 。
(2)在A~E五種物質中,互為同分異構體的是 (填代號)。
(3)寫出由A生成B的化學方程式
。
(4)已知HCHO分子中所有原子都在同一平面內,則在上述分子中所有的原子有可能都在同一平面的物質是 (填序號)。
(5)C能形成高聚物,該高聚物的結構簡式為 。
(6)寫出D與NaOH溶液共熱反應的化學方程式
。
19.(16分)肉
桂酸甲酯( )常用于調制具有草莓、葡萄、櫻桃、香子蘭等香味的食用香精
)常用于調制具有草莓、葡萄、櫻桃、香子蘭等香味的食用香精
⑴肉桂酸甲酯的分子式是 ;
 ⑵下列有關肉桂酸甲酯的敘述中,正確的是 填字母);
⑵下列有關肉桂酸甲酯的敘述中,正確的是 填字母);
A.能與溴的四氯化碳溶液發生加成反應
B.無法使酸性高錳酸鉀溶液褪色
C.在堿性條件下能發生水解反應
D.不可能發生加聚反應
⑶G為肉桂酸甲酯的一種同分異構體,其分子結構模型如右圖所示(圖中球與球之間連線表示單鍵或雙鍵)。則G的結構簡式為 ;
⑷用芳香烴A為原料合成G的路線如下:

①化合物E中的官能團有 (填名稱)。
②F→G的反應類型是 ,該反應的化學方程式為 _ _ 。
③C→D的化學方程式為 _。
④寫出符合下列條件的F的同分異構體的結構簡式 。O%M
ⅰ.分子內含苯環,且苯環上只有一個支鏈;
ⅱ.一定條件下,1mol該物質與足量銀氨溶液充分反應,生成4mol銀單質。
20.(10分)有機物A的蒸汽對同溫同壓下氫氣的相對密度為31,取3.1克A物質在足量氧氣中充分燃燒,只生成2.7克水和標準狀況下CO22.24L,求有機物的分子式;若該有機物0.2mol恰好與9.2克金屬鈉完全反應,請寫出有機物的結構簡式并命名。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com