
題目列表(包括答案和解析)
(10分) 某興趣小組進行“活潑金屬與酸反應”的實驗,將5.4g的鋁片投入500 mL 0.5 mol·L-1的硫酸溶液中,右圖為反應產生氫氣速率與反應時間的關系圖。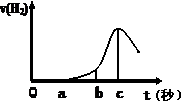
(1)關于圖像的描述不正確的是 (填序號,下同);
① o→a段不產生產生H2是室溫過低,反應難以發生。
② b → c段產生H2較快可能是反應放熱,溫度升高,加快了反應
③ c以后,產生H2速率逐漸下降原因可能是鋁片趨于消耗完全
(2)在b到c這段時間內,收集到氫氣VL(標準狀況),則這段時間內用硫酸表示的平均速率為 mol/(L·s)(假設反應前后溶液體積不變)。
(3)其他條件不變,現換用500 mL 1 mol·L-1鹽酸,產生氫氣速率普遍較使用500 mL 0.5 mol·L-1硫酸的快,可能的原因是________;
(4)要加快鋁與硫酸溶液制H2的反應速率,小組成員提出一系列方案,合理的有
①加入2 mol·L-1硝酸②加入少量CuSO4溶液 ③將鋁片換成鋁粉 ④增加硫酸的濃度至18 mol/L ⑤加CH3COONa固體; ⑥加入少量Na2SO4溶液
(5)催化劑會影響反應速率,請根據①反應寫出FeCl3催化H2O2分解的另一反應原理(用離子方程式)①2Fe3++ H2O2= 2Fe2++ 2H+ +O2↑;② ;
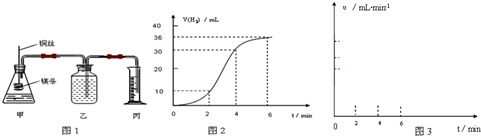
[實驗一]從鎂鋁合金片上剪下一小塊,先稱重,然后投到盛有10mL 10mol·L-1NaOH溶液(足量)的錐形瓶里。
(1)從反應開始至反應結束,依次可觀察到的現象有:①切口斷面處先產生氣泡,反應由慢到快;②小塊合金在溶液中上下翻騰;③溶液升溫;④反應后,溶液中殘留黑色固體。
(2)開始時產生氣泡速率慢,其主要原因(除溫度、電化學因素外)是___________。
(3)欲利用此反應測定合金中鋁的含量,請仿照方法①寫出另一種不同方法所需數據。
方法 | 需測定的數據 |
① | 測定產生的H2的體積 |
② |
|
[實驗二]向實驗一的錐形瓶里滴加1 mol·L-1HCl,使鎂、鋁兩種元素恰好只以氯化物的形式存在。寫出此過程中含鋁元素的化合物所發生的離子反應方程式:___________________。
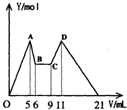
[實驗三]取實驗二的錐形瓶里的溶液10mL,向其中滴加amL c1 mol·L-1NaOH之后,改成滴加c2mol·L-1 HCl,所得沉淀Y(mol)與試劑總體積V(mL)間的關系如圖所示。據此,回答下列問題:

(1)圖中CD段消耗鹽酸的體積是AB段消耗的NaOH溶液體積的兩倍,則c1/c2=__________;
(2)所加入NaOH溶液的體積a=________mL。
 某化學興趣小組欲研究一種鎂鋁合金,以下是部分實驗.請完成填空.
某化學興趣小組欲研究一種鎂鋁合金,以下是部分實驗.請完成填空.| 方法 | 需測定的數據 |
| ① | 測定產生的H2的體積 |
| ② |
鈦被稱為繼鐵、鋁之后的第三金屬,也有人說“21世紀將是鈦的世紀”.
(1)二氧化鈦在現代社會里有廣泛的用途,它的產量是一個國家國民經濟發展程度的標志.我國至今產量不足,尚需進口二氧化鈦.“硫酸法”生產二氧化鈦的原料是鈦鐵礦(主要成分是:FeTiO3,還含有少量Mn、Zn、Cr、Cu等重金屬元素及脈石等雜質),主要生產流程是:
①將鈦鐵礦與濃H2SO4煮解:FeTiO3+2H2SO4(濃)===TiOSO4+FeSO4+2H2O(硫酸鈦酰)
②加水分解硫酸氧鈦:TiOSO4+(n+1)H2O===TiO2·nH2O+H2SO4
③
煅燒TiO2·nH2O“硫酸法”生產TiO2排放的廢液對水體有哪些污染,請指出主要的二點:
①________;
②________.
根據廢液主要成分,針對其中一項污染,提出處理的方法.③________
(2)某化學興趣小組對Mg、Ti、Cu三種金屬的金屬活動性順序進行探究.
提出假設:a.Ti金屬活動性比Mg強;b.Ti金屬活動性比Cu弱.
查閱資料:在相同條件下,金屬與酸反應產生氣泡的速度快,則該金屬活動性越強.
實驗設計:同溫下,取大小相同的這三種金屬薄片,用砂布將表面擦光亮,分別投入等體積等濃度的足量稀鹽酸和稀HF溶液中反應,觀察現象.
①稀鹽酸:放出H2速率Mg>Ti,銅不反應.②稀HF:放出H2速率Ti>Mg
根據上述________現象(填①或②)得出金屬活動性Mg________Ti.如何解釋另一反常現象________.
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com