
題目列表(包括答案和解析)
若定義某物質的轉化率為消耗掉的該物質的物質的量占起始時該物質的原物質的量的百分比。已知合成氨反應為N2(g) + 3H2(g) ![]() 2NH3(g).在一體積為10L且容積不變的密閉容器中放入1mol N2和3mol H2 ,在一定條件下發生反應,經4min達到化學平衡狀態,測得容器中氨氣的物質的量為0.6mol.。求:
2NH3(g).在一體積為10L且容積不變的密閉容器中放入1mol N2和3mol H2 ,在一定條件下發生反應,經4min達到化學平衡狀態,測得容器中氨氣的物質的量為0.6mol.。求:
(1)氮氣的轉化率
(2)用氫氣表示平均反應速率是多少?
(3)平衡狀態時氫氣的物質的量濃度。
HO—CH2—CH2—OH![]()
HO—CH2CH2—O—CH2CH2—OH![]()
HO—CH2CH2—O—CH2CH2—O—CH2CH2OH ![]()
(1)以![]() 的形式表示上述一系列醇醚的結構簡式:__________________。
的形式表示上述一系列醇醚的結構簡式:__________________。
(2)寫出上述同系列的分子式通式:________________
(3)推算該同系列化合物中碳元素的質量分數最大值為__________________。
(12分)測定平衡常數對定量認識化學反應具有重要意義。已知:I2能與I-反應成
I3-,并在溶液中建立如下平衡:I2 +I- I3-。通過測平衡體系中c(I2)、c(I-)和c(I3-),就可求得該反應的平衡常數。
I3-。通過測平衡體系中c(I2)、c(I-)和c(I3-),就可求得該反應的平衡常數。
I、某同學為測定上述平衡體系中c(I2),采用如下方法:取V1 mL平衡混合溶液,用c mol·L-1的Na2S2O3溶液進行滴定(反應為I2+2Na2S2O3=2NaI+Na2S4O6),消耗V2 mL的Na2S2O3溶液。根據V1、V2和c可求得c(I2)。
(1)上述滴定時,可采用_________做指示劑,滴定終點的現象是________。
(2)下列對該同學設計方案的分析,正確的是__________(填字母)。
A.方案可行。能準確測定溶液中的c(I2)
B.不可行。因為I-能與Na2S2O3發生反應
C.不可行。只能測得溶液中c(I2)與c(I3-)之和
Ⅱ、化學興趣小組對上述方案進行改進,擬采用下述方法來測定該反應的平衡常數(室溫條件下進行,溶液體積變化忽略不計):
已知:①I-和I3-不溶于CCl4;②一定溫度下碘單質在四氯化碳和水混合液體中,碘單質的濃度比值即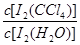 是一個常數(用Kd表示,稱為分配系數),且室溫條件下Kd=85。回答下列問題:
是一個常數(用Kd表示,稱為分配系數),且室溫條件下Kd=85。回答下列問題:
(3)操作Ⅰ使用的玻璃儀器中,除燒杯、玻璃棒外,還需要的儀器是______(填名稱)。
試指出該操作中應注意的事項為 。(任寫一條)
(4)下層液體中碘單質的物質的量濃度是__________。
(5)實驗測得上層溶液中c(I3-)="0.049" mol·L-1,結合上述有關數據,計算室溫條件下反應I2+I- I3-的平衡常數K=__________(用具體數據列出計算式即可)。)
I3-的平衡常數K=__________(用具體數據列出計算式即可)。)
 I3-。通過測平衡體系中c(I2)、c(I-)和c(I3-),就可求得該反應的平衡常數。
I3-。通過測平衡體系中c(I2)、c(I-)和c(I3-),就可求得該反應的平衡常數。
 是一個常數(用Kd表示,稱為分配系數),且室溫條件下Kd=85。回答下列問題:
是一個常數(用Kd表示,稱為分配系數),且室溫條件下Kd=85。回答下列問題: I3-的平衡常數K=__________(用具體數據列出計算式即可)。
I3-的平衡常數K=__________(用具體數據列出計算式即可)。 ②性質:a.同一元素的各同位素雖然質量數不同,但它們的_____________性質基本相同;
b.天然存在的某種元素里,不論是游離態還是化合態,各種同位素所占的原子百分數_____________;
c.許多元素有多種同位素,有的是天然的,有的是人工制造的,有的有放射性,有的沒有放射性。
③幾種重要同位素及其應用:a.在氫元素的三種同位素中,![]() 和
和![]() 可以制造___________;
可以制造___________;
b.鈾元素有![]() 、
、![]() 、
、![]() 等多種同位素,其中_______是制造原子彈的材料和核反應堆的燃料;
等多種同位素,其中_______是制造原子彈的材料和核反應堆的燃料;
c.碳元素有![]() 、
、![]() 、
、![]() 等幾種同位素,
等幾種同位素,![]() 可用于_______________________________;
可用于_______________________________;
d.同位素分穩定同位素和放射性同位素兩種,放射性同位素最常見的應用是____________和____________。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com