
題目列表(包括答案和解析)


利用海水資源進行化工生產的部分工藝流程如圖:

(1)流程I中,欲除去粗鹽中含有的Ca2+、Mg2+、SO42-等離子,需將粗鹽溶解后,按序加入藥品進行沉淀、過濾等。加入藥品和操作的順序可以是 。
a.Na2CO3、NaOH、BaCl2、過濾、鹽酸 b.NaOH、BaCl2、Na2CO3、過濾、鹽酸
c.NaOH、Na2CO3、BaCl2、過濾、鹽酸 d.BaCl2、Na2CO3、NaOH、過濾、鹽酸
(2)流程II中,電解飽和NaCl溶液的離子方程式為 。通電開始后,陽極區產生的氣體是 ,陰極附近溶液pH會 (填“增大”、“減小”或“不變”)。
(3)流程III中,通過反應得到NaHCO3晶體。下圖為NaCl、NH4Cl、NaHCO3、NH4HCO3的溶解度曲線,其中能表示NaHCO3溶解度曲線的是 ,化學反應方程式是 。

(4)流程IV中,所得純堿常含有少量可溶性雜質,提純它的過程如下:將碳酸鈉樣品加適量水溶解、 、 、過濾、洗滌2-3次,得到純凈Na2CO3•10H2O,Na2CO3•10H2O脫水得到無水碳酸鈉,已知:
Na2CO3·H2O(s)==Na2CO3(s)+H2O(g) ΔH1=+58.73kJ·mol-1
Na2CO3·10H2O(s)==Na2CO3·H2O(s)+9H2O(g) ΔH2= +473.63 kJ·mol-1
把該過程產生的氣態水完全液化釋放的熱能全部用于生產Na2CO3所需的能耗(不考慮能量損失),若生產1molNa2CO3需要耗能92.36kJ,由此得出:H2O(g)==H2O(l) △H = 。
利用海水資源進行化工生產的部分工藝流程如圖: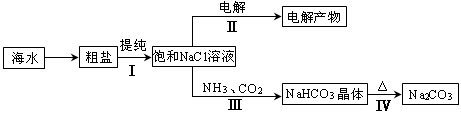
(1)流程I中,欲除去粗鹽中含有的Ca2+、Mg2+、SO42-等離子,需將粗鹽溶解后,按序加入藥品進行沉淀、過濾等。加入藥品和操作的順序可以是 。
a.Na2CO3、NaOH、BaCl2、過濾、鹽酸 b.NaOH、BaCl2、Na2CO3、過濾、鹽酸
c.NaOH、Na2CO3、BaCl2、過濾、鹽酸 d.BaCl2、Na2CO3、NaOH、過濾、鹽酸
(2)流程II中,電解飽和NaCl溶液的離子方程式為 。通電開始后,陽極區產生的氣體是 ,陰極附近溶液pH會 (填“增大”、“減小”或“不變”)。
(3)流程III中,通過反應得到NaHCO3晶體。下圖為NaCl、NH4Cl、NaHCO3、NH4HCO3的溶解度曲線,其中能表示NaHCO3溶解度曲線的是 ,化學反應方程式是 。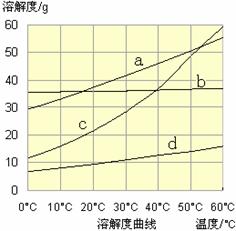
(4)流程IV中,所得純堿常含有少量可溶性雜質,提純它的過程如下:將碳酸鈉樣品加適量水溶解、 、 、過濾、洗滌2-3次,得到純凈Na2CO3?10H2O,Na2CO3?10H2O脫水得到無水碳酸鈉,已知:
Na2CO3·H2O(s)==Na2CO3(s)+H2O(g) ΔH1=+58.73kJ·mol-1
Na2CO3·10H2O(s)==Na2CO3·H2O(s)+9H2O(g) ΔH2=" +473.63" kJ·mol-1
把該過程產生的氣態水完全液化釋放的熱能全部用于生產Na2CO3所需的能耗(不考慮能量損失),若生產1molNa2CO3需要耗能92.36kJ,由此得出:H2O(g)==H2O(l) △H = 。
海水占地球總儲水量的97%。若把海水淡化和化工生產結合起來,既可以解決淡水資源缺乏的問題,又可以充分利用海洋資源。
(1)工業上利用電解飽和食鹽水可制得重要化工產品,又稱為“氯堿工業”。也可以電解熔融氯化鈉制得鈉和氯氣,該反應方程式為________________________。
(2)近年來有人提出了一種利用氯堿工業產品及氯化鈉循環治理含二氧化硫廢氣并回收二氧化硫的方法,該方法的流程如下: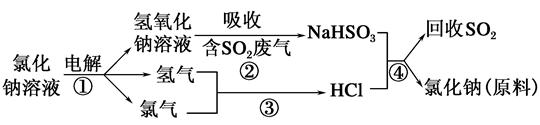
試寫出反應的化學方程式:
②__________,③__________,④__________。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com