二甲醚(CH
3OCH
3)是無色氣體,可作為一種新型能源.由合成氣(組成為H
2、CO和少量的CO
2)直接制備二甲醚,其中的主要過程包括以下四個反應:
甲醇合成反應:
(Ⅰ)CO(g)+2H
2(g)═CH
3OH(g)△H
1=-90.1kJ?mol
-1(Ⅱ)CO
2(g)+3H
2(g)═CH
3OH(g)+H
2O(g)△H
2=-49.0kJ?mol
-1水煤氣變換反應:
(Ⅲ)CO(g)+H
2O(g)═CO
2(g)+H
2 (g)△H
3=-41.1kJ?mol
-1二甲醚合成反應:
(Ⅳ)2CH
3OH(g)═CH
3OCH
3(g)+H
2O(g)△H
4=-24.5kJ?mol
-1回答下列問題:
(1)Al
2O
3是合成氣直接制備二甲醚反應催化劑的主要成分之一.工業上從鋁土礦制備較高純度Al
2O
3的主要工藝流程是
Al
2O
3(鋁土礦)+2NaOH+3H
2O=2NaAl(OH)
4,NaAl(OH)
4+CO
2=Al(OH)
3↓+NaHCO
3,2Al(OH)
3Al
2O
3+3H
2O
Al
2O
3(鋁土礦)+2NaOH+3H
2O=2NaAl(OH)
4,NaAl(OH)
4+CO
2=Al(OH)
3↓+NaHCO
3,2Al(OH)
3Al
2O
3+3H
2O
(以化學方程式表示).
(2)分析二甲醚合成反應(Ⅳ)對于CO轉化率的影響
消耗甲醇,促進甲醇合成反應(Ⅰ)平衡右移,CO轉化率增大;生成的H2O,通過水煤氣變換反應(Ⅲ)消耗部分CO
消耗甲醇,促進甲醇合成反應(Ⅰ)平衡右移,CO轉化率增大;生成的H2O,通過水煤氣變換反應(Ⅲ)消耗部分CO
.
(3)由H
2和CO直接制備二甲醚(另一產物為水蒸氣)的熱化學方程式為
2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=-204.7kJ?mol-1
2CO(g)+4H2(g)=CH3OCH3+H2O(g)△H=-204.7kJ?mol-1
.根據化學反應原理,分析增加壓強對直接制備二甲醚反應的影響
該反應分子數減少,壓強升高使平衡右移,CO和H2轉化率增大,CH3OCH3產率增加.壓強升高使CO和H2濃度增加,反應速率增大
該反應分子數減少,壓強升高使平衡右移,CO和H2轉化率增大,CH3OCH3產率增加.壓強升高使CO和H2濃度增加,反應速率增大
.
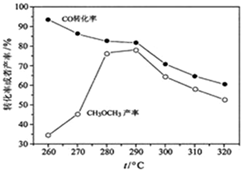
(4)有研究者在催化劑(含Cu-Zn-Al-O和Al
2O
3)、壓強為5.0MPa的條件下,由H
2和CO直接制備二甲醚,結果如圖所示.其中CO轉化率隨溫度升高而降低的原因是
反應放熱,溫度升高,平衡左移
反應放熱,溫度升高,平衡左移
.
(5)二甲醚直接燃料電池具有啟動快、效率高等優點,其能量密度等于甲醇直接燃料電池(5.93kW?h?kg
-1).若電解質為酸性,二甲醚直接燃料電池的負極反應為
CH3OCH3+3H2O=2CO2+12H++12e-
CH3OCH3+3H2O=2CO2+12H++12e-
,一個二甲醚分子經過電化學氧化,可以產生
12
12
個電子的能量;該電池的理論輸出電壓為1.20V,能量密度E=
(列式計算.能量密度=電池輸出電能/燃料質量,1kW?h=3.6×10
6J).

 二甲醚(CH3OCH3)是無色氣體,可作為一種新型能源.由合成氣(組成為H2、CO和少量的CO2)直接制備二甲醚,其中的主要過程包括以下四個反應:
二甲醚(CH3OCH3)是無色氣體,可作為一種新型能源.由合成氣(組成為H2、CO和少量的CO2)直接制備二甲醚,其中的主要過程包括以下四個反應: 5。
5。 單質同時放入水中,產生兩種無色氣體,有關的化學方程式為 、 。
單質同時放入水中,產生兩種無色氣體,有關的化學方程式為 、 。 。
。 7N2(g)+12H2O(g)也可處理NO2.則化學平衡常數表達式K=______;當轉移1.2mol電子時,消耗的NO2在標準狀況下是______L.
7N2(g)+12H2O(g)也可處理NO2.則化學平衡常數表達式K=______;當轉移1.2mol電子時,消耗的NO2在標準狀況下是______L. 7N2(g)+12H2O(g)也可處理NO2。則化學平衡常數表達式K=______;當轉移1.2mol電子時,消耗的NO2在標準狀況下是_______L。
7N2(g)+12H2O(g)也可處理NO2。則化學平衡常數表達式K=______;當轉移1.2mol電子時,消耗的NO2在標準狀況下是_______L。 
 CO2+H2(g) 反應過程中測定的部分數據見下表(表中t1>t2)
CO2+H2(g) 反應過程中測定的部分數據見下表(表中t1>t2) 
