
題目列表(包括答案和解析)
(13分)
第四周期過渡元素Fe、Ti可與C、H、N、O形成多種化合物。
(1)①H、C、N、O四種元素的電負(fù)性由小到大的順序?yàn)?u> 。
②下列敘述不正確的是 。(填字母)
A.因?yàn)镠CHO與水分子間能形成氫鍵,所以CH2O易溶于水
B.HCHO 和CO2分子中的中心原子均采用sp2雜化
C.C6H6分子中含有6個(gè)![]() 鍵和1個(gè)大
鍵和1個(gè)大![]() 鍵,C2H2是非極性分子
鍵,C2H2是非極性分子
D.CO2晶體的熔點(diǎn)、沸點(diǎn)都比二氧化硅晶體的低
③氰酸(HOCN)是一種鏈狀分子,它與異氰酸(HNCO)互為同分異構(gòu)體,其分子內(nèi)各原子最外層均已達(dá)到穩(wěn)定結(jié)構(gòu),試寫出氰酸的結(jié)構(gòu)式 。
(2) Fe原子或離子外圍有較多能量相近的空軌道能與一些分子或離子形成配合物。
①與Fe原子或離子形成配合物的分子或離子應(yīng)具備的結(jié)構(gòu)特征是
②六氰合亞鐵離子[Fe(CN)6]4-中不存在__________。
a、共價(jià)鍵 b、非極性鍵 c、配位鍵 d、σ鍵 e、π鍵
并寫出一種與 CN_ 互為等電子體的單質(zhì)分子式______________________。
③三氯化鐵常溫下為固體,熔點(diǎn),沸點(diǎn)
,在
:以上升華,易溶于水,也易溶于乙醚、丙酮等有機(jī)溶劑。據(jù)此判斷三氯化鐵的晶體類型為___________。
(3)①Ti的在周期表中位置______________ 。
根據(jù)元素原子的外電子排布的特征,可將元素周期表分成五個(gè)區(qū)域,其中Ti屬于 區(qū)。
②Ti的一種氧化物X,其晶胞結(jié)構(gòu)如上圖所示,則X的化學(xué)式為 。工業(yè)上利用X和碳酸鋇在熔融狀態(tài)下制取化合物M(M可看做一種含氧酸鹽),制備M的化學(xué)反應(yīng)方程式是________________________________________;
(13分)
第四周期過渡元素Fe、Ti可與C、H、N、O形成多種化合物。
(1)①H、C、N、O四種元素的電負(fù)性由小到大的順序?yàn)?u> 。
②下列敘述不正確的是 。(填字母)
A.因?yàn)镠CHO與水分子間能形成氫鍵,所以CH2O易溶于水
B.HCHO 和CO2分子中的中心原子均采用sp2雜化
C.C6H6分子中含有6個(gè) 鍵和1個(gè)大
鍵和1個(gè)大 鍵,C2H2是非極性分子
鍵,C2H2是非極性分子
D.CO2晶體的熔點(diǎn)、沸點(diǎn)都比二氧化硅晶體的低
③氰酸(HOCN) 是一種鏈狀分子,它與異氰酸(HNCO)互為同分異構(gòu)體
是一種鏈狀分子,它與異氰酸(HNCO)互為同分異構(gòu)體 ,其分子內(nèi)各原子最外層均已達(dá)到穩(wěn)定結(jié)構(gòu),試寫出氰酸的結(jié)構(gòu)式 。
,其分子內(nèi)各原子最外層均已達(dá)到穩(wěn)定結(jié)構(gòu),試寫出氰酸的結(jié)構(gòu)式 。
(2) Fe原子或離子外圍有較多能量相近的空軌道能與一些分子或離子形成配合物。
①與Fe原子或離子形成配合物的分子或離子應(yīng)具備的結(jié)構(gòu)特征是
②六氰合亞鐵離子[Fe(CN)6]4-中不存在__________。
a、共價(jià)鍵 b、非極性鍵 c、配位鍵 d、σ鍵 e、π鍵
并寫出一種與 CN_ 互為等電子體的單質(zhì)分子式______________________。
③三氯化鐵常溫下為固體,熔點(diǎn) ,沸點(diǎn)
,沸點(diǎn) ,在
,在  :以上升華,易溶于水,也易溶于乙醚、丙酮等有機(jī)溶劑。據(jù)此判斷三氯化鐵的晶體類型為___________。
:以上升華,易溶于水,也易溶于乙醚、丙酮等有機(jī)溶劑。據(jù)此判斷三氯化鐵的晶體類型為___________。
(3)①Ti的在周期表中位置______________ 。
根據(jù)元素原子的外電子排布的特征,可將元素周期表分成五個(gè)區(qū)域,其中Ti屬于 區(qū)。
②Ti的一種氧化物X,其晶胞結(jié)構(gòu)如上圖所示,則X的化學(xué)式為 。工業(yè)上利用X和碳酸鋇在熔融狀態(tài)下制取化合物M(M可看做一種含氧酸鹽),制 備M的化學(xué)反應(yīng)方程式是________________________________________;
備M的化學(xué)反應(yīng)方程式是________________________________________;
(13分)
第四周期過渡元素Fe、Ti可與C、H、N、O形成多種化合物。
(1)①H、C、N、O四種元素的電負(fù)性由小到大的順序?yàn)?u> 。
②下列敘述不正確的是 。(填字母)
A.因?yàn)镠CHO與水分子間能形成氫鍵,所以CH2O易溶于水
B.HCHO 和CO2分子中的中心原子均采用sp2雜化
C.C6H6分子中含有6個(gè)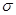 鍵和1個(gè)大
鍵和1個(gè)大 鍵,C2H2是非極性分子
鍵,C2H2是非極性分子
D.CO2晶體的熔點(diǎn)、沸點(diǎn)都比二氧化硅晶體的低
③氰酸(HOCN)是一種鏈狀分子,它與異氰酸(HNCO)互為同分異構(gòu)體,其分子內(nèi)各原子最外層均已達(dá)到穩(wěn)定結(jié)構(gòu),試寫出氰酸的結(jié)構(gòu)式 。
(2) Fe原子或離子外圍有較多能量相近的空軌道能與一些分子或離子形成配合物。
①與Fe原子或離子形成配合物的分子或離子應(yīng)具備的結(jié)構(gòu)特征是
②六氰合亞鐵離子[Fe(CN)6]4-中不存在__________。
a、共價(jià)鍵 b、非極性鍵 c、配位鍵 d、σ鍵 e、π鍵
并寫出一種與 CN_ 互為等電子體的單質(zhì)分子式______________________。
③三氯化鐵常溫下為固體,熔點(diǎn) ,沸點(diǎn)
,沸點(diǎn) ,在
,在
 :以上升華,易溶于水,也易溶于乙醚、丙酮等有機(jī)溶劑。據(jù)此判斷三氯化鐵的晶體類型為___________。
:以上升華,易溶于水,也易溶于乙醚、丙酮等有機(jī)溶劑。據(jù)此判斷三氯化鐵的晶體類型為___________。
(3)①Ti的在周期表中位置______________ 。
根據(jù)元素原子的外電子排布的特征,可將元素周期表分成五個(gè)區(qū)域,其中Ti屬于 區(qū)。

②Ti的一種氧化物X,其晶胞結(jié)構(gòu)如上圖所示,則X的化學(xué)式為 。工業(yè)上利用X和碳酸鋇在熔融狀態(tài)下制取化合物M(M可看做一種含氧酸鹽),制備M的化學(xué)反應(yīng)方程式是________________________________________;
(12分)A、B、C、D、E、F、G七種前四周期元素,其原子序數(shù)依次增大。A的原子中沒有成對電子;B的基態(tài)原子中電子占據(jù)三種能量不同的原子軌道,且每種軌道中的電子總數(shù)相同;D及其同主族元素的氫化物沸點(diǎn)變化趨勢如圖;F是地殼中含量最高的金屬元素;G與F同主族。請回答下列問題:
(1)寫出F元素基態(tài)原子的核外電子排布式 ;
(2)B、C、D三種元素電負(fù)性由大到小的順序是 (用元素符號表示);
(3)下列有關(guān)上述元素的說法,正確的是 (填序號);
①CA3沸點(diǎn)高于BA4,主要是因?yàn)榍罢呦鄬Ψ肿淤|(zhì)量較大
②Ni(BD)4常溫下為液態(tài),易溶于CCl4、苯等有機(jī)溶劑,因此固態(tài)Ni(BD)4屬于離子晶體
③C的氫化物的中心原子采取sp2雜化
④F單質(zhì)的熔點(diǎn)高于E單質(zhì),是因?yàn)?i>F單質(zhì)的金屬鍵較強(qiáng)
⑤比G的原子序數(shù)少1的元素第一電離能高于G
(4)CA3分子的空間構(gòu)型為 ,1 mol B2A4分子中含有 molσ鍵;
(5)ED是優(yōu)良的耐高溫材料,其晶體結(jié)構(gòu)與NaCl晶體相似。ED的熔點(diǎn)比NaCl高,其原因是 。
說明:O攝氏度=273K
【解析】原子中沒有成對電子只有氫元素,即A是H。基態(tài)原子中電子占據(jù)三種能量不同的原子軌道,說明這三種軌道分別是1s、2s和2p,又因?yàn)槊糠N軌道中的電子總數(shù)相同,所以B是C。根據(jù)氫化物沸點(diǎn)變化趨勢如圖可判斷,氫化物形成的晶體是分子晶體,但D的最高,沸點(diǎn)是100℃,說明氫化物中含有氫鍵,且D位于第二周期,故D是O。地殼中含量最高的金屬元素是Al,即F是Al。G與F同主族,G的原子序數(shù)最大,則G是Ga。由于A、B、C、D、E、F、G的原子序數(shù)依次增大,所以C是N。
(1)Al的原子序數(shù)是13,所以基態(tài)原子的核外電子排布式1S22S22P63S23P1。
(2)電負(fù)性是用來描述不同元素的原子對鍵合電子吸引了的大小,非金屬性越強(qiáng),電負(fù)性越大。C、N、O均屬于同一周期元素,原子序數(shù)逐漸增大,所以非金屬性逐漸增強(qiáng),即電負(fù)性大小順序?yàn)镺 > N > C
(3)氨氣中含有氫鍵所以其沸點(diǎn)高于甲烷的,①不正確。CCl4、苯等有機(jī)溶劑均屬于非極性分子,根據(jù)相似相溶原理可判斷Ni(CO)4應(yīng)為分子晶體,②不正確。氨氣分子中的中心原子有4對電子對,其中有1對孤電子對,所以空間構(gòu)型是三角錐形,采用sp3雜化,③不正確。鎂合鋁是金屬,形成的是金屬晶體,金屬原子半徑越小,金屬離子的電荷數(shù)越多,金屬鍵越強(qiáng),所以④正確。比G的原子序數(shù)少1的元素是鋅,由于鋅的核外電子均是全充滿,穩(wěn)定,所以其第一電離能要大于Ga,⑤正確。
(4)在CH2=CH2中含有4個(gè)C-H單鍵和1個(gè)碳碳雙鍵,而雙鍵又是又1個(gè)σ鍵和1個(gè) 鍵構(gòu)成的,所以1mol乙烯中含有5molσ鍵。
鍵構(gòu)成的,所以1mol乙烯中含有5molσ鍵。
(5)氧化鎂和氯化鈉均屬于離子晶體,形成離子晶體的離子鍵越強(qiáng),熔點(diǎn)越高。形成離子鍵的離子半徑越小,離子所帶電荷數(shù)越多,離子鍵越強(qiáng),鎂離子半徑小于鈉離子半徑氧離子半徑小于氯離子半徑,所以氧化鎂的熔點(diǎn)高于氯化鈉的。
(12分)A、B、C、D、E、F、G七種前四周期元素,其原子序數(shù)依次增大。A的原子中沒有成對電子;B的基態(tài)原子中電子占據(jù)三種能量不同的原子軌道,且每種軌道中的電子總數(shù)相同;D及其同主族元素的氫化物沸點(diǎn)變化趨勢如圖;F是地殼中含量最高的金屬元素;G與F同主族。請回答下列問題:
(1)寫出F元素基態(tài)原子的核外電子排布式 ;
(2)B、C、D三種元素電負(fù)性由大到小的順序是 (用元素符號表示);
(3)下列有關(guān)上述元素的說法,正確的是 (填序號);
①CA3沸點(diǎn)高于BA4,主要是因?yàn)榍罢呦鄬Ψ肿淤|(zhì)量較大
②Ni(BD)4常溫下為液態(tài),易溶于CCl4、苯等有機(jī)溶劑,因此固態(tài)Ni(BD)4屬于離子晶體
③C的氫化物的中心原子采取sp2雜化
④F單質(zhì)的熔點(diǎn)高于E單質(zhì),是因?yàn)?i>F單質(zhì)的金屬鍵較強(qiáng)
⑤比G的原子序數(shù)少1的元素第一電離能高于G
(4)CA3分子的空間構(gòu)型為 ,1 mol B2A4分子中含有 molσ鍵;
(5)ED是優(yōu)良的耐高溫材料,其晶體結(jié)構(gòu)與NaCl晶體相似。ED的熔點(diǎn)比NaCl高,其原因是 。
說明:O攝氏度=273K

【解析】原子中沒有成對電子只有氫元素,即A是H。基態(tài)原子中電子占據(jù)三種能量不同的原子軌道,說明這三種軌道分別是1s、2s和2p,又因?yàn)槊糠N軌道中的電子總數(shù)相同,所以B是C。根據(jù)氫化物沸點(diǎn)變化趨勢如圖可判斷,氫化物形成的晶體是分子晶體,但D的最高,沸點(diǎn)是100℃,說明氫化物中含有氫鍵,且D位于第二周期,故D是O。地殼中含量最高的金屬元素是Al,即F是Al。G與F同主族,G的原子序數(shù)最大,則G是Ga。由于A、B、C、D、E、F、G的原子序數(shù)依次增大,所以C是N。
(1)Al的原子序數(shù)是13,所以基態(tài)原子的核外電子排布式1S22S22P63S23P1。
(2)電負(fù)性是用來描述不同元素的原子對鍵合電子吸引了的大小,非金屬性越強(qiáng),電負(fù)性越大。C、N、O均屬于同一周期元素,原子序數(shù)逐漸增大,所以非金屬性逐漸增強(qiáng),即電負(fù)性大小順序?yàn)镺 > N > C
(3)氨氣中含有氫鍵所以其沸點(diǎn)高于甲烷的,①不正確。CCl4、苯等有機(jī)溶劑均屬于非極性分子,根據(jù)相似相溶原理可判斷Ni(CO)4應(yīng)為分子晶體,②不正確。氨氣分子中的中心原子有4對電子對,其中有1對孤電子對,所以空間構(gòu)型是三角錐形,采用sp3雜化,③不正確。鎂合鋁是金屬,形成的是金屬晶體,金屬原子半徑越小,金屬離子的電荷數(shù)越多,金屬鍵越強(qiáng),所以④正確。比G的原子序數(shù)少1的元素是鋅,由于鋅的核外電子均是全充滿,穩(wěn)定,所以其第一電離能要大于Ga,⑤正確。
(4)在CH2=CH2中含有4個(gè)C-H單鍵和1個(gè)碳碳雙鍵,而雙鍵又是又1個(gè)σ鍵和1個(gè) 鍵構(gòu)成的,所以1mol乙烯中含有5molσ鍵。
鍵構(gòu)成的,所以1mol乙烯中含有5molσ鍵。
(5)氧化鎂和氯化鈉均屬于離子晶體,形成離子晶體的離子鍵越強(qiáng),熔點(diǎn)越高。形成離子鍵的離子半徑越小,離子所帶電荷數(shù)越多,離子鍵越強(qiáng),鎂離子半徑小于鈉離子半徑氧離子半徑小于氯離子半徑,所以氧化鎂的熔點(diǎn)高于氯化鈉的。
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺 | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com