
題目列表(包括答案和解析)
| 品 名 | 濃縮菠蘿汁 |
| 配 料 | ①濃縮菠蘿汁 ②蔗糖 ③檸檬黃 ④山梨酸鉀 ⑤水 |
| 果汁含量 | ≥80% |
| 生產日期 | 標于包裝封口處 |
| 品 名 | 濃縮菠蘿汁 |
| 配 料 | ①濃縮菠蘿汁 ②蔗糖 ③檸檬黃 ④山梨酸鉀 ⑤水 |
| 果汁含量 | ≥80% |
| 生產日期 | 標于包裝封口處 |
| 催化劑 |
| 高溫 |
| 催化劑 |
| 高溫 |
實驗室合成環己酮的反應、裝置示意圖及有關數據如下:
 ?????????
????????? 
環己醇、環己酮、飽和食鹽水和水的部分物理性質見下表:
物質 | 沸點(℃) | 密度(g·cm-3, 20℃) | 溶解性 |
環己醇 | 161.1(97.8) | 0.9624 | 能溶于水 |
環己酮 | 155.6(95) | 0.9478 | 微溶于水 |
飽和食鹽水 | 108.0 | 1.3301 |
|
水 | 100.0 | 0.9982 |
|
括號中的數據表示該有機物與水形成的具有固定組成的混合物的沸點
(1)酸性Na2Cr2O7溶液氧化環己醇反應的ΔH<0,反應劇烈將導致體系溫度迅速上升,副反應增多。實驗中通過裝置B將酸性Na2Cr2O7溶液加到盛有環己醇的A中,在55~ 60℃進行反應。反應完成后,加入適量水,蒸餾,收集95 ~ 100℃的餾分,得到主要含環己酮粗品和水的混合物。
①如何滴加酸性Na2Cr2O7溶液 ????????????????????? ,用漂粉精和冰醋酸代替酸性Na2Cr2O7溶液也可氧化環己醇制環己酮,用漂粉精和冰醋酸氧化突出的優點是 ??????????? 。
②蒸餾不能分離環己酮和水的原因是 ????????????????????????????????? 。
(2)環己酮的提純需要經過以下一系列的操作:a.蒸餾,收集151~ 156℃餾分,b.過濾,c.在收集到的餾分中加NaCl固體至飽和,靜置,分液,d.加入無水MgSO4固體,除去有機物中少量水。
①上述操作的正確順序是 ?????????? (填字母)。
②上述操作b、c中使用的玻璃儀器除燒杯、錐形瓶、玻璃棒外,還需要的玻璃儀器有 ?? 。
③在上述操作c中,加入NaCl固體的作用是 ???????????????????????????? 。
(3)利用核磁共振氫譜可以鑒定制備的產物是否為環己酮,環己酮分子中有 種不同化學環境的氫原子。
|
下列說法正確的是 | |
| [ ] | |
A. |
SO2能使品紅溶液、溴水和酸性高錳酸鉀溶液褪色,是因為SO2具有漂白性 |
B. |
SO2和Cl2都有漂白作用,將等物質的量的兩種氣體同時作用于潮濕的有色物質時,可增強漂白作用 |
C. |
活性炭使有色物質褪色是利用了碳單質具有還原性,使有色物質發生還原反應 |
D. |
SO2使品紅溶液褪色后,將褪色后的溶液加熱,溶液重新變為紅色 |
非金屬知識規律總結
【高考導航】
一、非金屬元素在周期表中的位置和結構特點
1、除H外,非金屬元素均在“階梯線”的右上方。共有16種非金屬元素,其中包括稀有氣體元素6種。
2、非金屬元素(包括稀有元素)均在主族(零族)。非金屬元素一般都有變價。
3、最外層電子數一般≥4(H、B除外)。
4、原子半徑比同周期金屬半徑小(稀有元素除外)。
二、非金屬性強弱的判斷依據
元素非金屬性的本質是元素的原子吸引電子的能力。試題常通過以下幾個方面來比較元素的非金屬性:
1、單質跟H2化合難易程度(反應條件,劇烈程度,反應熱的大小,生成氣態氫化物的穩定性)。
2、最高價氧化物對應水化物的酸性。
3、化合物中元素化合價的正負,如BrCl中,Cl為-1價,Br為+1價,說明非金屬性Cl>Br。
4、通過氧化還原反應確定非金屬單質的氧化能力,進而比較非金屬性。
需要指出的是,非金屬單質的活動性與非金屬元素的活動性,有密切的聯系,但不是一回事。例如氮元素的非金屬性相當強,可是它的單質N2化學性質卻不很活潑。單質的化學性質不僅取決于原子結構,而且取決于分子結構和晶體結構。
三、非金屬元素的性質及遞變規律
1、單質:
(1)結構:除稀有氣體外,非金屬原子間以共價鍵結合。非金屬單質的成鍵有明顯的規律性。若它處在第N族,每個原子可提供8-N個價電子去和8-N個同種原子形成8-N個共價單鍵,可簡稱8-N規則;(H遵循2-N規則)。如ⅦA族單質:x-x;H的共價數為1,H-H,第ⅥA族的S、Se、Te共價單鍵數為8-6=2,第ⅤA族的P、As共價單鍵數8-5=3。但第二周期的非金屬單質中N2、O2形成多鍵。
(2)熔沸點與聚集態。它們可以分為三類:
①小分子物質。如:H2、O2、N2、Cl2等,通常為氣體,固體為分子晶體。
②多原子分子物質。如P4、S8、As4等,通常為液態或固態。均為分子晶體,但熔、沸點因范德華力較大而比①高,Br2、I2也屬此類,一般易揮發或升華。
③原子晶體類單質。如金剛石、晶體硅和硼等,是非金屬單質中高熔點“三角區”,通常為難揮發的固體。
(3)導電性:非金屬一般屬于非導體,金屬是良導體,而鍺、硅、砷、硒等屬于半導體。但半導體與導體不同之處是導電率隨溫度升高而增大。
(4)化學活性及反應:

③非金屬一般為成酸元素,難以與稀酸反應。 固體非金屬能被氧化性酸氧化。

2、氫化物:
(1)氣態氫化物性質比較
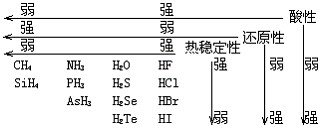
(2)由于氫鍵的存在,使得第ⅤA、ⅥA、ⅦA氫化物的熔沸點出現了反常。第ⅤA中:SbH3>NH3>AsH3>PH3;第ⅥA中: H2O>H2Te>H2Se>H2S;第ⅦA中HF>HI>HBr>HCl。
(3)氣態氫化物水溶液的酸堿性及與水作用的情況。①HCl、HBr、HI溶于水成酸且都是強酸。②HF、H2S、H2Se、H2Te溶于水成酸且都是弱酸。③NH3溶于水成堿,氨水是弱堿。④PH3、AsH3、CH4與水不反應。⑤SiH4、B2H6與水作用時分解并放出H2。
3、非金屬氧化物的通性:
(1)許多非金屬低價氧化物有毒,如SO2、NO、NO2、CO等,注意不能隨便排放于大氣中。
(2)非金屬氧化物(除SiO2外)大都是分子晶體,熔沸點相差不大。
(3)非金屬氧化物大都為酸酐,相應的酸易溶于水,則氧化物易與水化合,反之水化反應難以進行。
(4)不成鹽氧化物(如CO、NO)不溶于水,也不與堿反應。雖然NO2能與堿反應生成鹽,但NO2不屬于酸酐。
4、含氧酸
(1)同周期非金屬元素最高價含氧酸從左到右酸性增強。
(2)氧化性:同種元素低價強于高價含氧酸.
如:HClO>HClO3>HClO4(稀)
H2SO3>H2SO4(稀)
HNO2>HNO3(稀)
(3)對于同種非金屬形成的不同含氧酸,價態越高,酸性越強。其順序如:HClO4>HClO3>HClO2>HClO,H2SO4>H2SO3。
(4)難揮發的H2SO4、H3PO4受熱難分解;強氧化性的HNO3、HNO2、HClO見光或受熱易分解;非氧化性的H2CO3、H2SO3易分解。強酸可制弱酸,難揮發性酸制揮發性酸。
(5)常見含氧酸的一般性質:
①H2SO4:無色粘稠的油狀液體,強酸,沸點高,不揮發,穩定。濃硫酸有吸水性、脫水性和強氧化性。
②H2SO3:僅存在于溶液中,中強酸,不穩定。
③HClO4:在水溶液中相當穩定,最強無機酸,有強氧化性。
④HClO:僅存在于溶液中,是一種弱酸,有強氧化性和漂白性,極不穩定,遇光分解。⑤HNO3:無色液體,強酸,沸點低,易揮發,不穩定,易分解,有強氧化性。
⑥H3PO4:無色晶體,中強酸,難揮發,有吸水性,穩定,屬于非氧化性酸。
⑦H2CO3:僅存在于溶液中,弱酸,不穩定。
⑧H2SiO3:白色固體,不溶于水,弱酸,不揮發,加熱時可分解。
⑨常見酸的酸性強弱。強酸:HCl、HNO3、H2SO4;中強酸:H2SO3>H3PO4(H3PO4中強偏弱);弱酸:HF>CH3COOH>H2CO3>H2S>HClO>H2SiO3。
四、11種無機化學氣體的制取和性質(O2、H2、Cl2、CO、NO、SO2、NO2、CO2、H2S、HCl、NH3)。
(1)利用氧化還原反應原理制取的氣體有:O2、H2、Cl2、NO、NO2等。
(2)利用復分解制取的氣體有:SO2、CO2、H2S、HCl、NH3等。
(3)可用啟普發生器制取的氣體有:H2、CO2、H2S等。
(4)只能用排氣法收集的是:Cl2、SO2、NO2、CO2、H2S、HCl、NH3等。只能用排水法收集的氣體是:NO、CO。
(5)使紅色石蕊變藍的氣體是NH3;使石灰水變渾濁的氣體是SO2和CO2;使品紅溶液褪色的氣體是SO2和Cl2;使高錳酸鉀溶液和溴水褪色的氣體有H2S和SO2。
(6)臭雞蛋氣味的氣體是H2S;刺激性氣味的氣體有:Cl2、SO2、NO2、HCl、NH3等;毒性氣體有:Cl2、CO、NO、SO2、NO2、H2S等。
(7)能在空氣中燃燒的氣體:H2S、CO、H2等
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com