
題目列表(包括答案和解析)
| 化學鍵 | Cl-Cl | Br-Br | I-I | H-Cl | H-Br | H-I | H-H |
| 鍵能(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
| 1 |
| 2 |
| 1 |
| 2 |
已知1g氫氣完全燃燒生成液態水時放出熱量143kJ,18g水蒸氣變成液態水放出44kJ的熱量.其它相關數據如下表:
|
已知某種氣態化石燃料含有碳和氫兩種元素。為了
測定這種燃料中碳和氫兩種元素的質量分數,可將氣態燃料放入足量的氧氣中燃燒,并使產生的氣體全部通入如圖所示的裝置,得到如表所列的實驗數據(U形管中干燥劑只吸收水蒸氣且假設產生的氣體完全被吸收)。
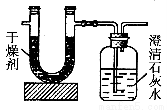
| 實驗前 | 實驗后 |
(干燥劑+U形管)的質量 | 101.1g | 102.9g |
(石灰水+廣口瓶)的質量 | 312.0g | 314.2g |
根據實驗數據求:
(1)實驗完畢后,生成物中水的質量為________g。假設廣口瓶里生成一種正鹽,其質量為________g。
(2)生成的水中氫元素的質量為________g。
(3)生成的CO2中碳元素的質量為________g。
(4)氣態化石燃料中碳元素與氫元素的質量比為________。
(12分)
(1)在250C、101KPa時,1g甲醇完全燃燒生成CO2和液態水時放熱22.68kJ,則能表示甲醇燃燒的熱化學方程式為:
________________________________________________________________________。
(2)已知:C(s)、CO(g)和H2(g)完全燃燒的熱化學方程式分別為:
C(s)+O2(g)=== CO2(g); △H=—394kJ·mol—1;
2CO(g)+O2(g)=== 2CO2(g); △H=—566kJ·mol—1;
2H2(g)+O2(g)=== 2H2O(g); △H=—484 kJ·mol—1;
①在25℃、101KPa時,1 g 甲醇不完全燃燒生成1∶1的CO、CO2和液態水,寫出此甲醇燃燒的熱化學方程式:
_____________________________________________________________________。
②工業上可由CO和H2合成甲醇。試寫出由C(s)與水蒸氣在高溫條件下反應生成氫氣
和一氧化碳的熱化學方程式 。
(3)利用甲醇可設計燃料電池。
①如用氫氧化鉀溶液做電解質溶液,用多孔石墨做電極,在電極上分別充入甲醇和氧
氣。寫出負極的電極反應式 。
②下列有關甲醇燃料電池的說法中,錯誤的是_________
A.甲醇燃料電池的負極發生氧化反應
B.甲醇燃料電池的電子由負極、經外電路流入正極
C.甲醇燃料電池在負極區產生CO![]()
D.甲醇燃料電池中使用的氫氧化鉀濃度保持不變
(12分)
(1)在250C、101KPa時,1g甲醇完全燃燒生成CO2和液態水時放熱22.68kJ,則能表示甲醇燃燒的熱化學方程式為:
________________________________________________________________________。
(2)已知:C(s)、CO(g)和H2(g)完全燃燒的熱化學方程式分別為:
C(s)+O2(g)="==" CO2(g); △H=—394kJ·mol—1;
2CO(g)+O2(g)="==" 2CO2(g); △H=—566kJ·mol—1;
2H2(g)+O2(g)="==" 2H2O(g); △H=—484 kJ·mol—1;
①在25℃、101KPa時,1 g甲醇不完全燃燒生成1∶1的CO、CO2和液態水,寫出此甲醇燃燒的熱化學方程式:
_____________________________________________________________________。
②工業上可由CO和H2合成甲醇。試寫出由C(s)與水蒸氣在高溫條件下反應生成氫氣
和一氧化碳的熱化學方程式 。
(3)利用甲醇可設計燃料電池。
①如用氫氧化鉀溶液做電解質溶液,用多孔石墨做電極,在電極上分別充入甲醇和氧
氣。寫出負極的電極反應式 。
②下列有關甲醇燃料電池的說法中,錯誤的是_________
A.甲醇燃料電池的負極發生氧化反應
B.甲醇燃料電池的電子由負極、經外電路流入正極
C.甲醇燃料電池在負極區產生CO
D.甲醇燃 料電池中使用的氫氧化鉀濃度保持不變
料電池中使用的氫氧化鉀濃度保持不變
高三化學
第I卷(選擇題,共48分)
一.選擇題(本題包括24小題,每小題2分,共48分。每小題只有一個選項符合題意。)
題號
1
2
3
4
5
6
7
8
9
10
答案
C
C
D
B
C
D
C
A
C
B
題號
11
12
13
14
15
16
17
18
19
20
答案
D
C
B
A
C
D
C
B
A
A
題號
21
22
23
24
答案
B
B
C
D
第II卷(共52分)
二.簡答題(本大題包括5小題,共45分。)
【考生注意】第25題分A、B兩題,考生可任選一題。若兩題均做,一律按A題計分。
25.(A題,8分)(1)畫出金屬元素與非金屬元素的分界線(2分)
Na
Cl
(2) IVA 族。(1分,其他答案均不給分)
(3)①見表中“Na”和“Cl”(各1分,寫成名稱或位置寫錯均不給分)。
② 氯 (填名稱,1分),化學反應方程式 Cl2+H2S=2HCl+S(2分,其他合理答案也給分) 。
25.(B題,8分)
Mg
Al
|