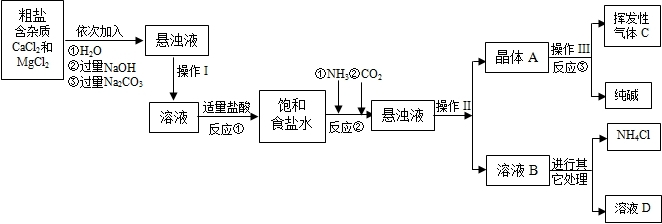
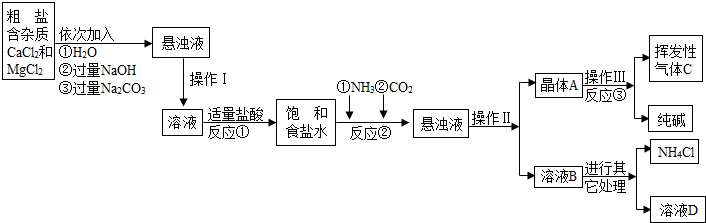
(2012?丹徒區三模)某校化學興趣小組參觀制堿廠后,獲得以下信息并對相關問題進行研究.
【查閱資料】
①該廠采用“侯氏制堿法”生產的化工產品為純堿和氯化銨.
②生產原料粗鹽中含有少量可溶性雜質(MgCl
2和CaCl
2)及不溶性雜質.
③生產原理:NaCl+NH
3+CO
2+H
2O=NaHCO
3↓+NH
4Cl,分離得晶體A,并使其充分受熱,即可分解制得純堿及兩種常見的氧化物,此反應的化學方程式為
.
④氯化銨分解的化學方程式是NH
4Cl
NH
3↑+HCl↑.
⑤部分生產流程如下圖所示:

【問題討論】
(1)溶液A中的溶質有NaCl和
NaOH
NaOH
、
Na2CO3
Na2CO3
,操作Ⅱ的名稱為
過濾
過濾
.
(2)上述流程中NaOH溶液的作用是除去粗鹽中的
MgCl2
MgCl2
.
(3)寫出加入Na
2CO
3溶液所發生反應的化學方程式
Na2CO3+CaCl2=CaCO3↓+2NaCl
Na2CO3+CaCl2=CaCO3↓+2NaCl
.
(4)上述生產流程中可循環使用的是
ABC
ABC
(填序號).
A.CO
2 B.NH
3 C.HCl D.NaOH
(5)根據上述信息,請你設計實驗區分碳酸鈉和碳酸氫鈉:
| 實驗步驟 |
實驗現象 |
實驗結論 |
取少量樣品中的一種放入試管中,塞上帶導管的單孔塞,導管另一端伸入澄清石灰水中.加熱固體并觀察現象. 取少量樣品中的一種放入試管中,塞上帶導管的單孔塞,導管另一端伸入澄清石灰水中.加熱固體并觀察現象. |
產生無色氣泡,澄清石灰水變渾濁 產生無色氣泡,澄清石灰水變渾濁 |
該樣品是NaHCO3否則是Na2CO3 該樣品是NaHCO3否則是Na2CO3 |
【組成確定】
稱取一定質量的純堿樣品,經多次充分加熱后,再稱重,質量無變化;
另取少量純堿樣品加入適量水,樣品完全溶解,向該溶液中加入過量稀HNO
3,再滴加AgNO
3溶液,有白色沉淀.
(6)由上述實驗可確定純堿樣品含有雜質
NaCl
NaCl
(寫化學式).
【含量測定】
同學們為了測定該純堿樣品的純度(假定只有(6)中的雜質),設計了如下實驗:
(7)甲組實驗:取10.0g純堿樣品,向其中加入過量的鹽酸,直至樣品中無氣泡冒出.充分加熱蒸發所得物質并干燥、冷卻至室溫后稱量,所得固體質量為10.9g.計算樣品中碳酸鈉的質量分數為(寫出計算過程,結果保留一位小數).
86.7%
86.7%

(8)乙組實驗:取10.0g純堿樣品,利用右圖所示裝置,測出反應后裝置C增重了3.5g(所加試劑均足量).實驗結束后,發現乙組測定的碳酸鈉質量分數偏小,其原因是
生成的二氧化碳氣體沒有完全被C中的燒堿吸收
生成的二氧化碳氣體沒有完全被C中的燒堿吸收
.



 某制堿廠以巖鹽水為主要原料生產純堿(Na2CO3)和其他副產品.
某制堿廠以巖鹽水為主要原料生產純堿(Na2CO3)和其他副產品.
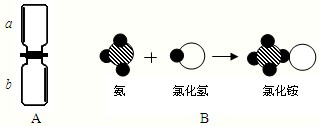 (2009?河西區一模)化學小魔術“空瓶生煙”方法如下圖A所示:a瓶中充滿氯化氫氣體,b 瓶中充滿氨氣,抽開毛玻璃片,瓶中產生濃濃的白煙.由此回答:
(2009?河西區一模)化學小魔術“空瓶生煙”方法如下圖A所示:a瓶中充滿氯化氫氣體,b 瓶中充滿氨氣,抽開毛玻璃片,瓶中產生濃濃的白煙.由此回答: ”表示氫原子,“
”表示氫原子,“ ”表示氮原子,“
”表示氮原子,“ ”表示氯原子,圖A中發生的反應過程如圖B所示.
”表示氯原子,圖A中發生的反應過程如圖B所示.