
題目列表(包括答案和解析)
 化學在能源開發與利用中起到十分關鍵的作用.氫氣是一種新型的綠色能源,又是一種重要的化工原料.
化學在能源開發與利用中起到十分關鍵的作用.氫氣是一種新型的綠色能源,又是一種重要的化工原料.| 1 |
| 2 |
| 1 |
| 2 |
| 物質的量/(mol)/時間(h) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0.00 | 0.20 | n2 | 1.00 | 1.00 |
(18分)化學在能源開發與利用中起到十分關鍵的作用。氫氣是一種新型的綠色能源,又是一種重要的化工原料。
Ⅰ (1)在298K、101kPa時,2g H2完全燃燒生成液態水,放出285.8kJ熱量。則表示氫氣燃燒熱的熱化學方程式為: 。
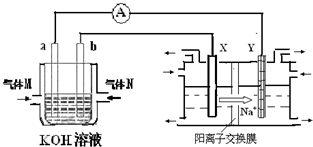
氫氧燃料電池能量轉化率高,具有廣闊的發展前景。現用氫氧燃料電池進行下圖飽和食鹽水電解實驗(圖中所用電極均為惰性電極)。分析該裝置、回答下列問題:
(2)氫氧燃料電池中,a電極為電池的是 (填“正極”或“負極”),氣體M的分子式 ,a電極上發生的電極反應式為: 。
(3)若右上圖裝置中盛有100mL5.0mol/LNaCl溶液,電解一段時間后須加入10.0mol/L鹽酸溶液50mL(密度為1.02g/mL)才能使溶液恢復至原來狀態。則在此電解過程中導線上轉移的電子數為 mol。(保留小數點后2位)
Ⅱ 氫氣是合成氨的重要原料。工業上合成氨的反應是:
N2(g)+3H2(g)2NH3 (g) ΔH=-92.2kJ·mol-1
(4)下列事實中,不能說明上述可逆反應已經達到平衡的是 。
① N2、H2 、NH3的體積分數不再改變;
② 單位時間內生成2n mol NH3的同時生成3n mol H2;
③ 單位時間內生成3n mol N—H鍵的同時生成n mol N≡N;
④ 用N2、H2 、NH3的物質的量濃度變化表示的反應速率之比為1:3:2;
⑤ 混合氣體的平均摩爾質量不再改變;
⑥ 混合氣體的總物質的量不再改變。
(5)已知合成氨反應在某溫度下2.00L的密閉容器中反應,測得如下數據:
根據表中數據計算:
①反應進行到2小時時放出的熱量為 kJ。
②0~1小時內N2的平均反應速率 mol·L-1·h-1。
③此條件下該反應的化學平衡常數K== (保留兩位小數)。
④反應達到平衡后,若往平衡體系中再加入N2、H2 和NH3各1 mol,化學平衡向 方向移動(填“正反應”或“逆反應”或“不移動”。)
(18分)化學在能源開發與利用中起到十分關鍵的作用。氫氣是一種新型的綠色能源,又是一種重要的化工原料。
Ⅰ (1)在298K、101kPa時,2g H2完全燃燒生成液態水,放出285.8kJ熱量。則表示氫氣燃燒熱的熱化學方程式為: 。
氫氧燃料電池能量轉化率高,具有廣闊的發展前景。現用氫氧燃料電池進行下圖飽和食鹽水電解實驗(圖中所用電極均為惰性電極)。分析該裝置、回答下列問題:
(2)氫氧燃料電池中,a電極為電池的是 (填“正極”或“負極”),氣體M的分子式 ,a電極上發生的電極反應式為: 。
(3)若右上圖裝置中盛有100mL5.0mol/LNaCl溶液,電解一段時間后須加入10.0mol/L鹽酸溶液50mL(密度為1.02g/mL)才能使溶液恢復至原來狀態。則在此電解過程中導線上轉移的電子數為 mol。(保留小數點后2位)
Ⅱ 氫氣是合成氨的重要原料。工業上合成氨的反應是:
N2(g)+3H2(g) 2NH3 (g) ΔH=-92.2kJ·mol-1
2NH3 (g) ΔH=-92.2kJ·mol-1
(4)下列事實中,不能說明上述可逆反應已經達到平衡的是 。
① N2、H2、NH3的體積分數不再改變;
② 單位時間內生成2n mol NH3的同時生成3n mol H2;
③ 單位時間內生成3n mol N—H鍵的同時生成n mol N≡N;
④ 用N2、H2、NH3的物質的量濃度變化表示的反應速率之比為1:3:2;
⑤ 混合氣體的平均摩爾質量不再改變;
⑥ 混合氣體的總物質的量不再改變。
(5)已知合成氨反應在某溫度下2.00L的密閉容器中反應,測得如下數據:
根據表中數據計算:
①反應進行到2小時時放出的熱量為 kJ。
②0~1小時內N2的平均反應速率 mol·L-1·h-1。
③此條件下該反應的化學平衡常數K== (保留兩位小數)。
④反應達到平衡后,若往平衡體系中再加入N2、H2和NH3各1 mol,化學平衡向 方向移動(填“正反應”或“逆反應”或“不移動”。)
(18分)化學在能源開發與利用中起到十分關鍵的作用。氫氣是一種新型的綠色能源,又是一種重要的化工原料。
Ⅰ (1)在298K、101kPa時,2g H2完全燃燒生成液態水,放出285.8kJ熱量。則表示氫氣燃燒熱的熱化學方程式為: 。
氫氧燃料電池能量轉化率高,具有廣闊的發展前景。現用氫氧燃料電池進行下圖飽和食鹽水電解實驗(圖中所用電極均為惰性電極)。分析該裝置、回答下列問題:

(2)氫氧燃料電池中,a電極為電池的是 (填“正極”或“負極”),氣體M的分子式 ,a電極上發生的電極反應式為: 。
(3)若右上圖裝置中盛有100mL5.0mol/LNaCl溶液,電解一段時間后須加入10.0mol/L鹽酸溶液50mL(密度為1.02g/mL)才能使溶液恢復至原來狀態。則在此電解過程中導線上轉移的電子數為 mol。(保留小數點后2位)
Ⅱ 氫氣是合成氨的重要原料。工業上合成氨的反應是:
N2(g)+3H2(g) 2NH3 (g) ΔH=-92.2kJ·mol-1
2NH3 (g) ΔH=-92.2kJ·mol-1
(4)下列事實中,不能說明上述可逆反應已經達到平衡的是 。
① N2、H2 、NH3的體積分數不再改變;
② 單位時間內生成2n mol NH3的同時生成3n mol H2;
③ 單位時間內生成3n mol N—H鍵的同時生成n mol N≡N;
④ 用N2、H2 、NH3的物質的量濃度變化表示的反應速率之比為1:3:2;
⑤ 混合氣體的平均摩爾質量不再改變;
⑥ 混合氣體的總物質的量不再改變。
(5)已知合成氨反應在某溫度下2.00L的密閉容器中反應,測得如下數據:

根據表中數據計算:
①反應進行到2小時時放出的熱量為 kJ。
②0~1小時內N2的平均反應速率 mol·L-1·h-1。
③此條件下該反應的化學平衡常數K== (保留兩位小數)。
④反應達到平衡后,若往平衡體系中再加入N2、H2 和NH3各1 mol,化學平衡向 方向移動(填“正反應”或“逆反應”或“不移動”。)
化學在能源開發與利用中起著十分關鍵的作用。氫氣是一種新型的綠色能源,又是一種重要的化工原料。
I.氫氧燃料電池能量轉化率高,具有廣闊的發展前景。現用氫氧燃料電池進行如圖實驗(圖中所用電極均為惰性電極):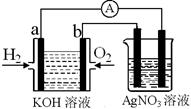
(1)對于氫氧燃料電池中,下列表達不正確的是________
| A.a電極是負極,OH-移向正極 |
| B.b電極的電極反應為:O2+2H2O+4e-=4OH- |
C.電池總反應式為:2H2+O2 2H2O 2H2O |
| D.電解質溶液的pH保持不變 |
 2NH3(g) ΔH=-92.20 kJ·mol-1。
2NH3(g) ΔH=-92.20 kJ·mol-1。| 時間(h) 物質的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | n2 | 1.00 | 1.00 |
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com