
題目列表(包括答案和解析)

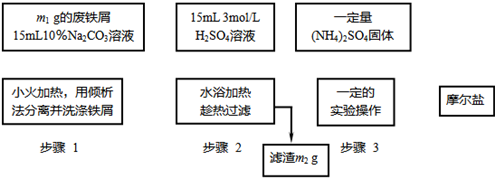
(16分)已知硫酸亞鐵銨晶體為淺綠色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有還原性,但比硫酸亞鐵穩定。
以下是將綠礬(FeSO4•7H2O)、硫酸銨以相等物質的量混合可制得摩爾鹽晶體的流程圖。根據下圖回答:

(1)為處理廢鐵屑表面的油污,用10%Na2CO3溶液清洗,請用離子方程式表示Na2CO3溶液呈堿性的原因: ▲ 。
(2)步驟1中采用傾析法分離出鐵屑,下列適合用傾析法的有 ▲ :
A.沉淀的顆粒較大 B.沉淀容易沉降 C.沉淀呈膠狀 D.沉淀呈絮狀
(3)步驟2中鐵屑過量的目的是(用離子方程式表示): ▲ 。步驟2中溶液趁熱過濾的原因是 ▲ 。
(4)步驟3中,加入(NH4)2SO4固體后,應加熱到 ▲ 時,停止加熱。需經過的實驗操作包括: ▲ 、 ▲ 、減壓過濾(或抽濾)等得到較為 ▲ 的晶體。
(5)抽濾裝置的儀器有: ▲ 、 ▲ 、安全瓶、抽氣泵組成。
(6)產品中Fe2+的定量分析:
制得的摩爾鹽樣品中往往含有極少量的Fe3+。為了測定摩爾鹽產品中Fe2+的含量,一般采用在酸性下用KMnO4標準液滴定的方法。
稱取4.0 g的摩爾鹽樣品,溶于水,并加入適量稀硫酸。用0.2 mo1/L KMnO4溶液滴定,當溶液中Fe2+全部被氧化時,消耗KMnO4溶液體積 10.00 mL。
①請完成滴定過程中發生的離子方程式:
Fe2+ + MnO4-+( )= Mn2+ + Fe3+ + H2O
②本實驗的指示劑 ▲ 。
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于 ▲ (酸式、堿式)滴定管中
④終點顏色的變化: ▲ 。
⑤產品中Fe2+的質量分數為 ▲ 。
(7)在25℃時,相同物質的量濃度的(NH4)2CO3、(NH4)2SO4、摩爾鹽三種鹽溶液a,b,c,其銨根離子濃度由小到大的排列順序為: ▲ 。(用a,b,c回答)
(16分)已知硫酸亞鐵銨晶體為淺綠色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有還原性,但比硫酸亞鐵穩定。
以下是將綠礬(FeSO4?7H2O)、硫酸銨以相等物質的量混合可制得摩爾鹽晶體的流程圖。根據下圖回答:
(1)為處理廢鐵屑表面的油污,用10%Na2CO3溶液清洗,請用離子方程式表示Na2CO3溶液呈堿性的原因: ▲ 。
(2)步驟1中采用傾析法分離出鐵屑,下列適合用傾析法的有 ▲ :
A.沉淀的顆粒較大 B.沉淀容易沉降 C.沉淀呈膠狀 D.沉淀呈絮狀
(3)步驟2 中鐵屑過量的目的是(用離子方程式表示): ▲ 。步驟2中溶液趁熱過濾的原因是 ▲ 。
中鐵屑過量的目的是(用離子方程式表示): ▲ 。步驟2中溶液趁熱過濾的原因是 ▲ 。
(4)步驟3中,加入(NH4)2SO4固體后,應 加熱到 ▲ 時,停止加熱。需經過的實驗操作包括: ▲ 、 ▲ 、減壓過濾(或抽濾)等得到較為 ▲ 的晶體。
加熱到 ▲ 時,停止加熱。需經過的實驗操作包括: ▲ 、 ▲ 、減壓過濾(或抽濾)等得到較為 ▲ 的晶體。
(5)抽濾裝置的儀器有: ▲ 、 ▲ 、安全瓶、抽氣泵組成。
(6)產品中Fe2+的定量分析:
制得的摩爾鹽樣品中往往含有極少量的Fe3+。為了測定摩爾鹽產品中Fe2+的含 量,一般采用在酸性下用KMnO4標準液滴定的方法。
量,一般采用在酸性下用KMnO4標準液滴定的方法。
稱取4.0 g的摩爾鹽樣品,溶于水,并加入適量稀硫酸。用0.2 mo1/L KMnO4溶液滴定,當溶液中Fe2+全部被氧化時,消耗KMnO4溶液體積 10.00 mL。
①請完成滴定過程中發生的離子方程式:
Fe2++ MnO4-+( )=" " Mn2++ Fe3++ H2O
②本實驗的指示劑 ▲ 。
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于 ▲ (酸式、堿式)滴定管中
④終點顏色的變化: ▲ 。
⑤產品中Fe2+的質量分數為 ▲ 。 (7)在25℃時,相同物質的量濃度的(NH4)2 CO3、(NH4)2SO4、摩爾鹽三種鹽溶液a,b,c,其銨根離子濃度由小到大的排列順序為: ▲ 。(用a,b,c回答)
(7)在25℃時,相同物質的量濃度的(NH4)2 CO3、(NH4)2SO4、摩爾鹽三種鹽溶液a,b,c,其銨根離子濃度由小到大的排列順序為: ▲ 。(用a,b,c回答)
(16分)已知硫酸亞鐵銨晶體為淺綠色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有還原性,但比硫酸亞鐵穩定。
以下是將綠礬(FeSO4•7H2O)、硫酸銨以相等物質的量混合可制得摩爾鹽晶體的流程圖。根據下圖回答:
(1)為處理廢鐵屑表面的油污,用10%Na2CO3溶液清洗,請用離子方程式表示Na2CO3溶液呈堿性的原因: ▲ 。
(2)步驟1中采用傾析法分離出鐵屑,下列適合用傾析法的有 ▲ :
A.沉淀的顆粒較大 B.沉淀容易沉降 C.沉淀呈膠狀 D.沉淀呈絮狀
(3)步驟2中鐵屑過量的目的是(用離子方程式表示): ▲ 。步驟2中溶液趁熱過濾的原因是 ▲ 。
(4)步驟3中,加入(NH4)2SO4固體后,應加熱到 ▲ 時,停止加熱。需經過的實驗操作包括: ▲ 、 ▲ 、減壓過濾(或抽濾)等得到較為 ▲ 的晶體。
(5)抽濾裝置的儀器有: ▲ 、 ▲ 、安全瓶、抽氣泵組成。
(6)產品中Fe2+的定量分析:
制得的摩爾鹽樣品中往往含有極少量的Fe3+。為了測定摩爾鹽產品中Fe2+的含量,一般采用在酸性下用KMnO4標準液滴定的方法。
稱取4.0 g的摩爾鹽樣品,溶于水,并加入適量稀硫酸。用0.2 mo1/L KMnO4溶液滴定,當溶液中Fe2+ 全部被氧化時,消耗KMnO4溶液體積 10.00 mL。
①請完成滴定過程中發生的離子方程式:
Fe2+ + MnO4-+( )= Mn2+ + Fe3+ + H2O
②本實驗的指示劑 ▲ 。
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于 ▲ (酸式、堿式)滴定管中
④終點顏色的變化: ▲ 。
⑤產品中Fe2+的質量分數為 ▲ 。
(7)在25℃時,相同物質的量濃度的(NH4)2 CO3、(NH4)2SO4、摩爾鹽三種鹽溶液a,b,c,其銨根離子濃度由小到大的排列順序為: ▲ 。(用a,b,c回答)
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com