
題目列表(包括答案和解析)
 W、X、Y、Z是四種常見的短周期元素,其原子半徑隨原子序數變化如圖所示.已知W的一種核素的質量數為18,中子數為10;X和Ne原子的核外電子數相差1;Y的單質是一種常見的半導體材料;Z是
W、X、Y、Z是四種常見的短周期元素,其原子半徑隨原子序數變化如圖所示.已知W的一種核素的質量數為18,中子數為10;X和Ne原子的核外電子數相差1;Y的單質是一種常見的半導體材料;Z是

非金屬知識規律總結
【高考導航】
一、非金屬元素在周期表中的位置和結構特點
1、除H外,非金屬元素均在“階梯線”的右上方。共有16種非金屬元素,其中包括稀有氣體元素6種。
2、非金屬元素(包括稀有元素)均在主族(零族)。非金屬元素一般都有變價。
3、最外層電子數一般≥4(H、B除外)。
4、原子半徑比同周期金屬半徑小(稀有元素除外)。
二、非金屬性強弱的判斷依據
元素非金屬性的本質是元素的原子吸引電子的能力。試題常通過以下幾個方面來比較元素的非金屬性:
1、單質跟H2化合難易程度(反應條件,劇烈程度,反應熱的大小,生成氣態氫化物的穩定性)。
2、最高價氧化物對應水化物的酸性。
3、化合物中元素化合價的正負,如BrCl中,Cl為-1價,Br為+1價,說明非金屬性Cl>Br。
4、通過氧化還原反應確定非金屬單質的氧化能力,進而比較非金屬性。
需要指出的是,非金屬單質的活動性與非金屬元素的活動性,有密切的聯系,但不是一回事。例如氮元素的非金屬性相當強,可是它的單質N2化學性質卻不很活潑。單質的化學性質不僅取決于原子結構,而且取決于分子結構和晶體結構。
三、非金屬元素的性質及遞變規律
1、單質:
(1)結構:除稀有氣體外,非金屬原子間以共價鍵結合。非金屬單質的成鍵有明顯的規律性。若它處在第N族,每個原子可提供8-N個價電子去和8-N個同種原子形成8-N個共價單鍵,可簡稱8-N規則;(H遵循2-N規則)。如ⅦA族單質:x-x;H的共價數為1,H-H,第ⅥA族的S、Se、Te共價單鍵數為8-6=2,第ⅤA族的P、As共價單鍵數8-5=3。但第二周期的非金屬單質中N2、O2形成多鍵。
(2)熔沸點與聚集態。它們可以分為三類:
①小分子物質。如:H2、O2、N2、Cl2等,通常為氣體,固體為分子晶體。
②多原子分子物質。如P4、S8、As4等,通常為液態或固態。均為分子晶體,但熔、沸點因范德華力較大而比①高,Br2、I2也屬此類,一般易揮發或升華。
③原子晶體類單質。如金剛石、晶體硅和硼等,是非金屬單質中高熔點“三角區”,通常為難揮發的固體。
(3)導電性:非金屬一般屬于非導體,金屬是良導體,而鍺、硅、砷、硒等屬于半導體。但半導體與導體不同之處是導電率隨溫度升高而增大。
(4)化學活性及反應:

③非金屬一般為成酸元素,難以與稀酸反應。 固體非金屬能被氧化性酸氧化。

2、氫化物:
(1)氣態氫化物性質比較
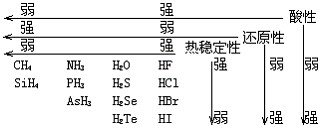
(2)由于氫鍵的存在,使得第ⅤA、ⅥA、ⅦA氫化物的熔沸點出現了反常。第ⅤA中:SbH3>NH3>AsH3>PH3;第ⅥA中: H2O>H2Te>H2Se>H2S;第ⅦA中HF>HI>HBr>HCl。
(3)氣態氫化物水溶液的酸堿性及與水作用的情況。①HCl、HBr、HI溶于水成酸且都是強酸。②HF、H2S、H2Se、H2Te溶于水成酸且都是弱酸。③NH3溶于水成堿,氨水是弱堿。④PH3、AsH3、CH4與水不反應。⑤SiH4、B2H6與水作用時分解并放出H2。
3、非金屬氧化物的通性:
(1)許多非金屬低價氧化物有毒,如SO2、NO、NO2、CO等,注意不能隨便排放于大氣中。
(2)非金屬氧化物(除SiO2外)大都是分子晶體,熔沸點相差不大。
(3)非金屬氧化物大都為酸酐,相應的酸易溶于水,則氧化物易與水化合,反之水化反應難以進行。
(4)不成鹽氧化物(如CO、NO)不溶于水,也不與堿反應。雖然NO2能與堿反應生成鹽,但NO2不屬于酸酐。
4、含氧酸
(1)同周期非金屬元素最高價含氧酸從左到右酸性增強。
(2)氧化性:同種元素低價強于高價含氧酸.
如:HClO>HClO3>HClO4(稀)
H2SO3>H2SO4(稀)
HNO2>HNO3(稀)
(3)對于同種非金屬形成的不同含氧酸,價態越高,酸性越強。其順序如:HClO4>HClO3>HClO2>HClO,H2SO4>H2SO3。
(4)難揮發的H2SO4、H3PO4受熱難分解;強氧化性的HNO3、HNO2、HClO見光或受熱易分解;非氧化性的H2CO3、H2SO3易分解。強酸可制弱酸,難揮發性酸制揮發性酸。
(5)常見含氧酸的一般性質:
①H2SO4:無色粘稠的油狀液體,強酸,沸點高,不揮發,穩定。濃硫酸有吸水性、脫水性和強氧化性。
②H2SO3:僅存在于溶液中,中強酸,不穩定。
③HClO4:在水溶液中相當穩定,最強無機酸,有強氧化性。
④HClO:僅存在于溶液中,是一種弱酸,有強氧化性和漂白性,極不穩定,遇光分解。⑤HNO3:無色液體,強酸,沸點低,易揮發,不穩定,易分解,有強氧化性。
⑥H3PO4:無色晶體,中強酸,難揮發,有吸水性,穩定,屬于非氧化性酸。
⑦H2CO3:僅存在于溶液中,弱酸,不穩定。
⑧H2SiO3:白色固體,不溶于水,弱酸,不揮發,加熱時可分解。
⑨常見酸的酸性強弱。強酸:HCl、HNO3、H2SO4;中強酸:H2SO3>H3PO4(H3PO4中強偏弱);弱酸:HF>CH3COOH>H2CO3>H2S>HClO>H2SiO3。
四、11種無機化學氣體的制取和性質(O2、H2、Cl2、CO、NO、SO2、NO2、CO2、H2S、HCl、NH3)。
(1)利用氧化還原反應原理制取的氣體有:O2、H2、Cl2、NO、NO2等。
(2)利用復分解制取的氣體有:SO2、CO2、H2S、HCl、NH3等。
(3)可用啟普發生器制取的氣體有:H2、CO2、H2S等。
(4)只能用排氣法收集的是:Cl2、SO2、NO2、CO2、H2S、HCl、NH3等。只能用排水法收集的氣體是:NO、CO。
(5)使紅色石蕊變藍的氣體是NH3;使石灰水變渾濁的氣體是SO2和CO2;使品紅溶液褪色的氣體是SO2和Cl2;使高錳酸鉀溶液和溴水褪色的氣體有H2S和SO2。
(6)臭雞蛋氣味的氣體是H2S;刺激性氣味的氣體有:Cl2、SO2、NO2、HCl、NH3等;毒性氣體有:Cl2、CO、NO、SO2、NO2、H2S等。
(7)能在空氣中燃燒的氣體:H2S、CO、H2等
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com