
題目列表(包括答案和解析)
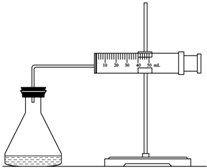 實驗室用H2O2分解反應制取氧氣時,常加入催化劑以加快反應速率,某研究性學習小組為研究催化劑FeCl3的量對O2生成速率的影響,設計了如下三組實驗方案(見下表),將表中所給的試劑按一定體積混合后進行反應.
實驗室用H2O2分解反應制取氧氣時,常加入催化劑以加快反應速率,某研究性學習小組為研究催化劑FeCl3的量對O2生成速率的影響,設計了如下三組實驗方案(見下表),將表中所給的試劑按一定體積混合后進行反應.| 實驗編號 試劑 |
A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/mL | 0 | 5.0 | 10.0 |
| H2O/mL | V3 | V4 | 0 |
(9分)實驗室用H2O2分解反應制取氧氣時,常加入催化劑以加快反應速率,某研究性學習小組為研究催化劑FeCl3的量對O2生成速率的影響,設計了如下三組實驗方案(見下表),將表中所給的試劑按一定體積混合后進行反應。
| 實驗編號 試劑 | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/ mL | 0 | 5.0 | 10.0 |
| H2O/ mL | V3 | V4 | 0 |

(9分)實驗室用H2O2分解反應制取氧氣時,常加入催化劑以加快反應速率,某研究性學習小組為研究催化劑FeCl3的量對O2生成速率的影響,設計了如下三組實驗方案(見下表),將表中所給的試劑按一定體積混合后進行反應。
| 實驗編號 試劑 | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/ mL | 0 | 5.0 | 10.0 |
| H2O/ mL | V3 | V4 | 0 |
按要求回答下列問題:
(1)欲用右圖裝置來比較該反應的反應速率快慢,當反應物的濃度、用量及其他影響速率的條件確定之后,可以通過測 推(計)算反應速率。
(2)為實現實驗目的,則V1= ,V2= ;
V3= ,V4= 。
(3)根據你所掌握的知識判斷,在上述實驗中反應速率最快的可能是 (填“實驗編號”)
(4)已知Fe3+催化H2O2分解的機理可分兩步反應進行,其中第一步反應為:2Fe3+ + H2O2 ==2Fe2++ O2↑+ 2H+,則第二步反應的離子方程式為:
。
【解析】(1)因為反應中生成氧氣,所以可以通過收集相同體積的氣體所需要的時間來進行計算。
(2)為使實驗在相同條件下進行雙氧水的量應該相同,且最終溶液的體積要相同,所以V1=20.00ml,V2=20.00ml,V3=10.00ml,V4=5.00ml。
(3)C中催化劑的量最多,所以反應速率可能最快。
(4)因為催化劑在反應前后是不能變的,所以在第二步中亞鐵離子要重新生成鐵離子,因此正確的反應式為2Fe2+ + H2O2 +2H+ == 2Fe3+ + 2H2O。
(9分)實驗室用H2O2分解反應制取氧氣時,常加入催化劑以加快反應速率,某研究性學習小組為研究催化劑FeCl3的量對O2生成速率的影響,設計了如下三組實驗方案(見下表),將表中所給的試劑按一定體積混合后進行反應。
|
實驗編號 試劑 |
A |
B |
C |
|
10% H2O2/mL |
20.0 |
V1 |
V2 |
|
2mol/L FeCl3/ mL |
0 |
5.0 |
10.0 |
|
H2O/ mL |
V3 |
V4 |
0 |
按要求回答下列問題:
(1)欲用右圖裝置來比較該反應的反應速率快慢,當反應物的濃度、用量及其他影響速率的條件確定之后,可以通過測 推(計)算反應速率。
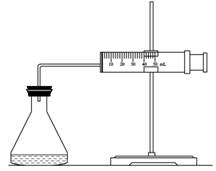
(2)為實現實驗目的,則V1= ,V2= ;
V3= ,V4= 。
(3)根據你所掌握的知識判斷,在上述實驗中反應速率最快的可能是 (填“實驗編號”)
(4)已知Fe3+催化H2O2分解的機理可分兩步反應進行,其中第一步反應為:2Fe3+ + H2O2 ==2Fe2+ + O2↑+ 2H+,則第二步反應的離子方程式為:
。
【解析】(1)因為反應中生成氧氣,所以可以通過收集相同體積的氣體所需要的時間來進行計算。
(2)為使實驗在相同條件下進行雙氧水的量應該相同,且最終溶液的體積要相同,所以V1=20.00ml,V2=20.00ml,V3=10.00ml,V4=5.00ml。
(3)C中催化劑的量最多,所以反應速率可能最快。
(4)因為催化劑在反應前后是不能變的,所以在第二步中亞鐵離子要重新生成鐵離子,因此正確的反應式為2Fe2+ + H2O2 + 2H+ == 2Fe3+ + 2H2O。
| 實驗編號 試劑 | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/ mL | 0 | 5.0 | 10.0 |
| H2O/ mL | V3 | V4 | 0 |
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com