
題目列表(包括答案和解析)
甲醇是一種可再生能源,具有開發和應用的廣闊前景,工業上一般可采用如下反應來合成甲醇:
CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(1)分析該反應并回答下列問題:
①平衡常數表達式為K=____________。
②下列各項中,不能說明該反應已達到平衡的是________(填序號)。
a.恒溫、恒容條件下,容器內的壓強不發生變化
b.一定條件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定條件下,CO、H2和CH3OH的濃度保持不變
d.一定條件下,單位時間內消耗2 mol CO,同時生成1 mol CH3OH
(2)如圖是該反應在不同溫度下CO的轉化率隨時間變化的曲線。
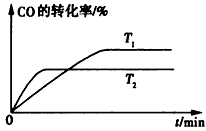
①該反應的焓變△H____(填“>”、“<”或 “=”)0。
②T1和T2溫度下的平衡常數大小關系是K1____ (填“>”、“<”或“=”)K2。
③若容器容積不變,下列措施可增加甲醇產率的是____
a.升高溫度
b.將CH3OH(g)從體系中分離出來
c.使用合適的催化劑
d.充入He,使體系總壓強增大
(3)已知在常溫常壓下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-a kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H=-b kJ/mol
③H2O(g)=H2O(l) △H=-c kJ/mol
則CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H =____kJ/mol。
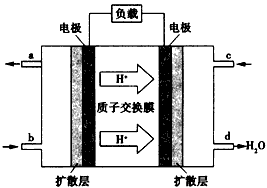
(4)已知甲醇燃料電池的工作原理如圖所示。
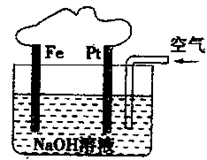
| A.該裝置內可發生原電池反應 |
| B.該裝置中Pt為正極,電極反應為:O2+2H2O+4e-=4OH- |
| C.溶液中會出現紅褐色的沉淀 |
| D.該裝置中Fe為陰極,電極反應為:Fe—2e-+2OH-=Fe(OH)2 |
有關如圖所示裝置的敘述不正確的是
A.該裝置內可發生原電池反應
B.該裝置中Pt為正極,電極反應為:O2+2H2O+4e-=4OH-
C.該裝置中Fe為陰極,電極反應為 Fe—2e-+2OH-=Fe(OH)2
D.溶液中會出現紅褐色的沉淀

有關如圖所示裝置的敘述不正確的是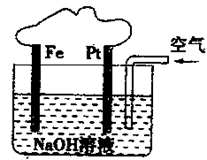
| A.該裝置內可發生原電池反應 |
| B.該裝置中Pt為正極,電極反應為:O2+2H2O+4e-=4OH- |
| C.溶液中會出現紅褐色的沉淀 |
| D.該裝置中Fe為陰極,電極反應為:Fe—2e-+2OH-=Fe(OH)2 |

| c(CH3OH) |
| c(CO)?c2H(2) |
| c(CH3OH) |
| c(CO)?c2H(2) |
物理部分:
一.選擇題
14.ABC 15.AC 16.ACD 17.C 18.C 19.BCD 20.BD 21.D
22.實驗題:
(I)①ACD ②AD
(II)①直流毫安表應選 C ,直流電壓表應選 D 。
②在方框內畫出實驗電路圖:(分壓.外接)
23.解析:(1)由閉合電路歐姆定律:
E=U1+ E=U2+
E=U2+
|