
題目列表(包括答案和解析)
(12分)能源短缺是人類社會面臨的重大問題。甲醇是一種可再生能源,具有廣泛的開發和應用前景。工業上合成甲醇的反應為:CO(g)+2H2(g)CH3OH(g);ΔH
(1)已知,該反應在300℃,5MPa條件下能自發進行,則ΔH 0,△S 0 (填“<,>或=”)。
(2)在300℃,5MPa條件下,將0.20mol的 CO與0.58mol H2的混合氣體充入2L密閉容器發生反應,反應過程中甲醇的物質的量濃度隨時間的變化如圖所示。
①在0~2min內,以H2表示的平均反應速率為 mol·L-1·s-1。
②列式計算300℃時該反應的平衡常數K = 。
③300℃時,將0.50mol CO、1.00mol H2和1.00 molCH3OH充入容積為2L的密閉容器中,此時反應將 。
A.向正方向移動 B.向逆方向移動 C.處于平衡狀態 D.無法判斷
④下列措施可增加甲醇產率的是
A.壓縮容器體積 B.將CH3OH(g)從體系中分離
C.充入He,使體系總壓強增大 D.再充入0.20mol CO和0.58mol H2
(3)若其它條件不變,使反應在500℃下進行,在圖中作出甲醇的物質的量濃度隨時間的變化的示意圖。
【解析】(1)根據反應的特點可知△S小于0,因為反應在300℃,5MPa條件下能自發進行,所以根據△G=△H-T·△S可知反應是放熱反應。
(2)①反應速率通常用單位時間內濃度的變化量來表示,根據圖像可知反應進行到2min時甲醇
的濃度不再發生變化,平衡時甲醇的物質的量是0.04mol,則消耗氫氣是0.08mol,所以在0~2min
內,以H2表示的平均反應速率為![]() 。
。
②平衡時氫氣的濃度是![]() ,CO的平衡濃度是
,CO的平衡濃度是
![]() ,所以該溫度下的平衡常數為
,所以該溫度下的平衡常數為![]() 。
。
③300℃時,將0.50mol CO、1.00mol H2和1.00 molCH3OH充入容積為2L的密閉容器中,此時它們的濃度分別為0.25mol/L、0.50mol/L、、0.50mol/L,因為![]() >4,所以反應向逆反應方向移動。
>4,所以反應向逆反應方向移動。
④壓縮體積,壓強增大,平衡向正反應方向移動。選項B是降低生成物濃度,平衡也向正反應方
向移動。充入He,使體系總壓強增大,但物質但濃度沒有變化,所以平衡不移動。再充入0.20mol
CO和0.58mol H2,相當于增大體系的壓強,平衡向正反應方向移動,所以答案是ABD。
(3)因為反應是放熱反應,所以升高溫度平衡向逆反應方向移動,但反應速率會加快,所以圖
像為
(12分)能源短缺是人類社會面臨的重大問題。甲醇是一種可再生能源,具有廣泛的開發和應用前景。工業上合成甲醇的反應為:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH
(1)已知,該反應在300℃,5MPa條件下能自發進行,則ΔH 0,△S 0 (填“<,>或=”)。
(2)在300℃,5MPa條件下,將0.20mol的 CO與0.58mol H2的混合氣體充入2L密閉容器發生反應,反應過程中甲醇的物質的量濃度隨時間的變化如圖所示。

①在0~2min內,以H2表示的平均反應速率為 mol·L-1·s-1 。
②列式計算300℃時該反應的平衡常數K = 。
③300℃時,將0.50mol CO、1.00mol H2和1.00 mol CH3OH充入容積為2L的密閉容器中,此時反應將 。
A.向正方向移動 B.向逆方向移動 C.處于平衡狀態 D.無法判斷
④下列措施可增加甲醇產率的是
A.壓縮容器體積 B.將CH3OH(g)從體系中分離
C.充入He,使體系總壓強增大 D.再充入0.20mol CO和0.58mol H2
(3)若其它條件不變,使反應在500℃下進行,在圖中作出甲醇的物質的量濃度隨時間的變化的示意圖。
【解析】(1)根據反應的特點可知△S小于0,因為反應在300℃,5MPa條件下能自發進行,所以根據△G=△H-T·△S可知反應是放熱反應。
(2)①反應速率通常用單位時間內濃度的變化量來表示,根據圖像可知反應進行到2min時甲醇
的濃度不再發生變化,平衡時甲醇的物質的量是0.04mol,則消耗氫氣是0.08mol,所以在0~2min
內,以H2表示的平均反應速率為 。
。
②平衡時氫氣的濃度是 ,CO的平衡濃度是
,CO的平衡濃度是
 ,所以該溫度下的平衡常數為
,所以該溫度下的平衡常數為 。
。
③300℃時,將0.50mol CO、1.00mol H2和1.00 mol
CH3OH充入容積為2L的密閉容器中,此時它們的濃度分別為0.25mol/L、0.50mol/L、、0.50mol/L,因為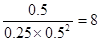 >4,所以反應向逆反應方向移動。
>4,所以反應向逆反應方向移動。
④壓縮體積,壓強增大,平衡向正反應方向移動。選項B是降低生成物濃度,平衡也向正反應方
向移動。充入He,使體系總壓強增大,但物質但濃度沒有變化,所以平衡不移動。再充入0.20mol
CO和0.58mol H2,相當于增大體系的壓強,平衡向正反應方向移動,所以答案是ABD。
(3)因為反應是放熱反應,所以升高溫度平衡向逆反應方向移動,但反應速率會加快,所以圖
像為

(16分)下表為長式周期表的一部分,其中的編號代表對應的元素。
| ① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ② |
|
|
|
|
|
|
|
|
|
|
| ③ | ④ | ⑤ | ⑥ |
|
|
| ⑦ |
|
|
|
|
|
|
|
|
|
|
|
|
| ⑧ |
|
|
|
|
|
|
|
| ⑨ |
|
|
|
| ⑩ |
|
|
|
|
|
|
|
(1)寫出上表中元素⑨原子的外圍電子排布式 。
(2)在元素③與①形成的水果催熟劑氣體化合物中,元素③的雜化方式為:
(3)按要求完成下列各題
a.第一電離能:元素④ 元素⑤(選填“>”、“=”、“<”)。
b.與元素④所形成的單質互為等電子體的分子、離子的化學式 、 (各寫一種)。
c.元素④的氣態氫化物X的水溶液在微電子工業中,可作刻蝕劑H2O2的清除劑,所發生反應的產物不污染環境,其化學方程式為________________________________
d.由X與氧氣、KOH溶液構成原電池,負極會產生元素④的單質。則其負極反應式為_____________________________。
(4)由元素③和⑧形成的液態化合物Z,是非極性的直線形分子。0.2mol的Z在O2中完全燃燒,生成兩種氣態氧化物,298K時放出熱量215kJ。該反應的熱化學方程式為_________________________
(5)在測定①與⑥形成化合物的相對分子質量時,實驗測得的值一般高于理論值的主要原因是: 。
(6)元素⑩所形成的單質晶體中原子的堆積方式如下圖甲所示,其晶胞特征如下圖乙所示,原子之間相互位置關系的平面圖如下圖丙所示。 已知該原子的半徑為d pm,相對原子質量為M,NA代表阿伏加德羅常數,請回答:
晶體中該原子的配位數為 ,一個晶胞中包含的原子數目為 ;該晶體的密度為 g·cm-3(用字母表示,不必化簡)。
【解析】考查元素周期表的結構和元素周期律的應用。根據元素在周期表中的物質可判斷,①是H,②是Be,③是C,④是N,⑤是O,⑥是F,⑦是Mg,⑧S,⑨是Cr,⑩是Cu。
(1)因為全充滿或半充滿是穩定的,所以根據構造原理可知Cr的外圍電子排布式3d54s1。
(2)③與①形成的水果催熟劑是乙烯,乙烯中含有碳碳雙鍵,采用的是sp2雜化。
非金屬性越強,第一電離能越大,所以N<O。氮氣中含有14個電子,所以和氮氣互為等電子體的分子是CO,離子是C22-。N的氫化物是氨氣,N的化合價處于最低價態,被雙氧水氧化生成氮氣。原電池中負極失去電子,所以氨氣在負極的電極反應式為2NH3-6e-+6OH-===N2+6H2O。
(4)S和C形成的非極性的直線形分子是CS2,所以反應的熱化學方程式為CS2(l)+3O2(g)===CO2(g)+2SO2(g) ΔH=-1075 kJ/mol
(5)F是最活潑的非金屬元素,H和F形成的氫化物中含有氫鍵,從而導致測得的值一般高于理論值。
(6)銅形成的是面心立方最密堆積,其配位數是12,根據乙中的結構特點可知一個晶胞中包含的原子數目為![]()
![]() 8×1/8+6×1/2=4。根據丙圖可知該晶胞的邊長為
8×1/8+6×1/2=4。根據丙圖可知該晶胞的邊長為 ,所以其密度為
,所以其密度為
(16分)下表為長式周期表的一部分,其中的編號代表對應的元素。
|
① |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
② |
|
|
|
|
|
|
|
|
|
|
|
③ |
④ |
⑤ |
⑥ |
|
|
|
⑦ |
|
|
|
|
|
|
|
|
|
|
|
|
|
⑧ |
|
|
|
|
|
|
|
|
⑨ |
|
|
|
|
⑩ |
|
|
|
|
|
|
|
(1)寫出上表中元素⑨原子的外圍電子排布式 。
(2)在元素③與①形成的水果催熟劑氣體化合物中,元素③的雜化方式為:
(3)按要求完成下列各題
a.第一電離能:元素④ 元素⑤(選填“>”、“=”、“<”)。
b.與元素④所形成的單質互為等電子體的分子、離子的化學式 、 (各寫一種)。
c.元素④的氣態氫化物X的水溶液在微電子工業中,可作刻蝕劑H2O2的清除劑,所發生反應的產物不污染環境,其化學方程式為________________________________
d.由X與氧氣、KOH溶液構成原電池,負極會產生元素④的單質。則其負極反應式為_____________________________。
(4)由元素③和⑧形成的液態化合物Z,是非極性的直線形分子。0.2mol的Z在O2中完全燃燒,生成兩種氣態氧化物,298K時放出熱量215kJ。該反應的熱化學方程式為_________________________
(5)在測定①與⑥形成化合物的相對分子質量時,實驗測得的值一般高于理論值的主要原因是: 。
(6)元素⑩所形成的單質晶體中原子的堆積方式如下圖甲所示,其晶胞特征如下圖乙所示,原子之間相互位置關系的平面圖如下圖丙所示。 已知該原子的半徑為d pm,相對原子質量為M,NA代表阿伏加德羅常數,請回答:

晶體中該原子的配位數為 ,一個晶胞中包含的原子數目為 ;該晶體的密度為 g·cm-3(用字母表示,不必化簡)。
【解析】考查元素周期表的結構和元素周期律的應用。根據元素在周期表中的物質可判斷,①是H,②是Be,③是C,④是N,⑤是O,⑥是F,⑦是Mg,⑧S,⑨是Cr,⑩是Cu。
(1)因為全充滿或半充滿是穩定的,所以根據構造原理可知Cr的外圍電子排布式3d54s1。
(2)③與①形成的水果催熟劑是乙烯,乙烯中含有碳碳雙鍵,采用的是sp2雜化。
非金屬性越強,第一電離能越大,所以N<O。氮氣中含有14個電子,所以和氮氣互為等電子體的分子是CO,離子是C22-。N的氫化物是氨氣,N的化合價處于最低價態,被雙氧水氧化生成氮氣。原電池中負極失去電子,所以氨氣在負極的電極反應式為2NH3-6e-+6OH-===N2+6H2O。
(4)S和C形成的非極性的直線形分子是CS2,所以反應的熱化學方程式為CS2(l)+3O2(g)===CO2(g)+2SO2(g) ΔH=-1075 kJ/mol
(5)F是最活潑的非金屬元素,H和F形成的氫化物中含有氫鍵,從而導致測得的值一般高于理論值。
(6)銅形成的是面心立方最密堆積,其配位數是12,根據乙中的結構特點可知一個晶胞中包含的原子數目為
 8×1/8+6×1/2=4。根據丙圖可知該晶胞的邊長為
8×1/8+6×1/2=4。根據丙圖可知該晶胞的邊長為 ,所以其密度為
,所以其密度為
(9分)A、B、C、D是中學化學中常見的四種化合物,它們分別由兩種元素組成.甲、乙、丙是單質,甲、丙、A、C、D常溫下均為氣體,B為液體.這些單質和化合物之間存在如下關系:
(1)寫出下列物質的分子式:A_______ 甲_______、丙_______.
(2)寫出單質甲跟化合物C反應,生成SO2和化合物B的化學方程式_____________.
(3)標準狀況下將28L化合物A與足量的過氧化鈉充分反應轉移電子的數目為
(4)在密閉容器中,化合物B跟化合物D在高溫下生成化合物A和單質丙的反應是可逆反應,其化學方程式為__________。
(5)化合物C的穩定性比化合物B (填強或弱)。
【解析】本題屬于無機框圖題,關鍵是尋找突破點。常見的液體是水,則B是水。單質和化合物反應生成SO2和水的反應,根據原子守恒可知甲應是氧氣,C是H2S。單質和氣態化合物反應生成另外一種氣態化合物的,常見的是CO2和C的反應生成CO,因此A是CO2,D是CO,乙是C。CO在高溫下和水蒸氣反應又生成CO2和氫氣,所以丙是氫氣。
(1)(2)(4)略
(3)28LCO2的物質的量是![]() 。CO2和過氧化鈉反應的方程式為2CO2+2Na2O2=2Na2CO3+O2↑,在反應中過氧化鈉既是氧化劑也是還原劑,轉移的電子是2,所以當消耗1.25mol是轉移的電子數目為1.25NA。
。CO2和過氧化鈉反應的方程式為2CO2+2Na2O2=2Na2CO3+O2↑,在反應中過氧化鈉既是氧化劑也是還原劑,轉移的電子是2,所以當消耗1.25mol是轉移的電子數目為1.25NA。
(5)S的非金屬性弱于O的,所以H2S的穩定性弱于H2O的。
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com