
題目列表(包括答案和解析)
已知甲、乙溶質質量分數與密度的關系如下表:
溶質質量分數 | 甲溶液密度(g/cm3) | 乙溶液密度(g/cm3) |
1% | 0.95 | 1.02 |
5% | 0.92 | 1.04 |
10% | 0.90 | 1.07 |
甲物質的1%的溶液與9%的溶液等體積混合,乙物質的1%的溶液與9%的溶液等體積混合后,下列敘述正確的是
A.混合后甲、乙溶液質量分數均大于5%
B.混合后乙溶液質量分數大于5%,甲溶液質量分數小于5%
C.混合后甲溶液質量分數大于5%,乙溶液質量分數小于5%
D.混合后甲、乙溶液質量分數均等于5%
溶質質量分數 | 甲溶液密度(s/cm3) | 乙溶液密度(g/cm3) |
1% | 0.95 | 1.02 |
5% | 0.92 | 1.04 |
10% | 0.90 | 1.07 |
甲物質的1%溶液與9%的溶液等體積混合,乙物質1%的溶液與9%的溶液等質量混合后,則下列敘述正確的是( )
A.混合后甲、乙溶液的濃度均大于5%
B.混合后乙溶液的濃度大于5%;甲溶液濃度小于5%
C.混合后乙溶液的濃度等于5%;甲溶液濃度小于5%
D.混合后甲、乙兩溶液均等于5%
(14分)工業上一般在恒容密閉容器中可以采用下列反應合成甲醇:
CO(g) + 2H2(g)  CH3OH(g) ΔH
CH3OH(g) ΔH
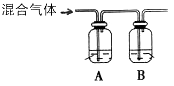
(1)下表所列數據是該反應在不同溫度下的化學平衡常數(K)。
| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |

| 容器 | 甲 | 乙 | 丙 | |
| 反應物投入量 | 1 mol CO、2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
| 平衡時數據 | CH3OH的濃度(mol/L) | c1 | c2 | c3 |
| 反應放出或吸收的能量 | x kJ | y kJ | z kJ | |
| 反應物轉化率 | Ф1 | Ф2 | Ф3 | |
 CH3OH(g) ΔH
CH3OH(g) ΔH| 溫度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反應物投入量 | 1 mol CO、2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
| 平衡時數據 | CH3OH的濃度(mol/L) | c1 | c2 | c3 |
| 反應放出或吸收的能量 | x kJ | y kJ | z kJ | |
| 反應物轉化率 | Ф1 | Ф2 | Ф3 | |
(21分)工業上一般在恒容密閉容器中用H2和CO生產燃料甲醇,反應方程式為
CO(g)+2H2(g) CH3OH(g)△H
CH3OH(g)△H
(1)下表所列數據是反應在不同溫度下的化學平衡常數(K)。
| 溫度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反應物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 時 的 數 據 | CH3OH濃度(mol/L) | c1 | c2 | c3 |
| 反應的能量變化 | akJ | bkJ | ckJ | |
| 體系壓強(Pa) | p1 | p2 | p3 | |
| 反應物轉化率 | α1 | α2 | α3 | |
一、1.解析:設原溶液中水的質量為w g,R的質量為 m g,R的溶解度為S g,則有:

根據比例性質,可設:?

S= ×100=
×100=
答案:B?
2.解析:注意體積效應。?
答案:B?
3.解析:因H2SO4溶液的密度隨濃度增大而增大,是一個變值而不是一個定值。設稀釋后溶液密度為ρ′,則有:18× ×10-3=9×
×10-3=9× ×10-3,2
×10-3,2 =
= ,因為
,因為
ρ′<ρ,故V<100(mL)。
答案:A?
4.解析:NH3+2O2===HNO3+H2O?
HNO3%= ×100%=78%
×100%=78%
答案:A
5.AB 6.B 7.B 8.D 9.C?
二、10.
11.
 g
g
12.(1)G、E、C、H、F(或E、G、C、H、F)?
(2)BCD
14.(1)0.0813 mol?L-1 (2)32 mL?
15.(1)四種?
①KOH,K2CO3 ②K2CO3 ③K2CO3,KHCO3?④KHCO3?
(2)解:2KOH+CO2 === K2CO3+H2O?
22.4 138?
2.24 x=13.8?
KOH+CO2===KHCO3?
22.4 100?
2.24 x=10.0?
從上面兩方程知:生成的固體全部是K2CO3時應該是 =0.100 mol
=0.100 mol
若K2CO3為a mol,則KHCO3為(0.100-a)mol?
則得方程
即K2CO3和KHCO3各為0.050 mol?
K2CO3為:
KHCO3為:
依K+守恒的要求,設KOH溶液濃度為c則:?
0.300 Lc=0.050 mol×2+0.050 mol c=0.50 mol?L-1
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com