
題目列表(包括答案和解析)
碳酸鈉與工農業生產、日常生活緊密相關。工業碳酸鈉大多采用侯氏制堿法制取,所得碳酸鈉樣品中往往含有少量NaCl,現欲測定樣品中Na2CO3的質量分數,某探究性學習小組分別設計了如下實驗方案。請回答下列有關問題:
方案一:沉淀分析法
(1)把一定質量的樣品溶解后加入過量的CaCl2溶液,將所得沉淀________(填操作)、洗滌、烘干、稱量。洗滌沉淀的操作是 ______________________________ 。
方案二:氣體分析法
(2)把一定量的樣品與足量鹽酸反應后,用下圖裝置測定產生CO2氣體的體積,為了測量結果準確,B中的溶液最好采用___________________,但選用該溶液后實驗結果仍然不夠準確,其原因是_______________________。
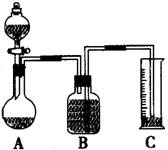
方案三:質量差分析法
(3)把一定質量的樣品和足量的稀硫酸反應,采用下圖所示裝置,通過稱量反應前后盛有堿石灰的干燥管質量,利用其質量差求算樣品的純度。
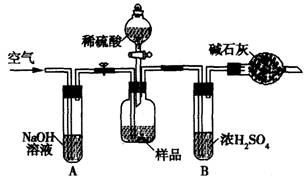
該實驗的操作步驟有:①在干燥管內填滿堿石灰,質量為mg ②取ng樣品裝入廣口瓶中
③檢驗裝置的氣密性 ④緩慢鼓人空氣數分鐘,再稱量干燥管質量為Mg ⑤關閉止水夾
⑥打開止水夾 ⑦緩慢加入稀硫酸至不再產生氣體為止 ⑧緩慢鼓人空氣數分鐘
Ⅰ.正確的操作順序是(填寫序號):③→_________→⑥→______⑤→________⑦→______
Ⅱ.在操作④中,要緩慢鼓人空氣數分鐘,鼓人空氣的作用是_________ ;裝置A的作用是 _________;裝置B的作用是 _____________。
Ⅲ.若去掉裝置A,測定結果______________ ;若去掉裝置B,測定結果_________ (填“偏大”、“偏小”或“無影響”)。

| H+ |
氨是一種重要的化工產品,是氮肥工業及制造硝酸的原料。為探究氨氣的性質,某研究性學習小組做了以下實驗:

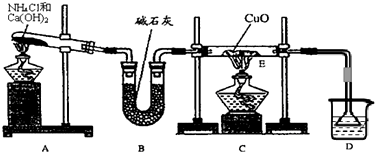
⑴ 實驗室用A圖所示實驗裝置及化學藥品(其中堿石灰為固體氫氧化鈉和生石灰的混合物來制取氨氣。
① 實驗室制取氨氣的化學方程式為 。
② 若用加熱碳酸氫銨固體制取純凈的氨氣,你認為裝置中U型管的作用是
。
⑵ 在實驗中發現E裝置中的固體由黑色變為紅色,可推測氨氣具有 性。
⑶ 某同學查閱資料發現Cu2O粉末也呈紅色,因此推測上述紅色固體中可能還含有Cu2O。已知:① Cu2O是堿性氧化物,在酸性溶液中Cu+不穩定,易轉化為Cu和Cu2+。
② 在空氣中高溫灼燒時:Cu2O穩定、不分解,而CuO將分解生成Cu2O和O2。
現有濃硝酸、稀硫酸、稀硝酸、氫氧化鈉溶液及pH試紙,而沒有其他試劑,請用最簡便的實驗方法證明紅色固體中是否含有Cu2O。(簡述操作方法、現象和結論)
![]() ⑷ 現有一份一定質量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同時生成4.48L NO(標準狀況),向所得溶液中加入一定體積1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀經洗滌、充分灼燒可得32.0g固體。下列有關說法正確的是【已知:3Cu2O + 14HNO3(稀) 6Cu(NO3)2 + 2NO↑+ 7H2O】___________
⑷ 現有一份一定質量Cu和Cu2O混合物,向其中加入0.4L 3.0mol/L稀硝酸,混合物完全溶解,同時生成4.48L NO(標準狀況),向所得溶液中加入一定體積1.0mol/L NaOH溶液恰好使Cu2+沉淀完全,沉淀經洗滌、充分灼燒可得32.0g固體。下列有關說法正確的是【已知:3Cu2O + 14HNO3(稀) 6Cu(NO3)2 + 2NO↑+ 7H2O】___________
A.加入NaOH溶液的體積為1.2L
B.Cu和Cu2O混合物質量為27.2g
C.混合物完全溶解后溶液中n(H+)=0.3mol
D.將等質量混合物完全還原至少需標準狀況下H21.12L
(12分)Na2CO3俗稱純堿、蘇打,NaHCO3俗稱小蘇打,兩者在日常生活和工業生產中都有著廣泛的應用。某化學興趣小組設計了如下實驗來探究兩者的某些性質。請你根據所學知識幫他們完成有關的設計和實驗。
(1)甲同學測定兩者的酸堿性:各取一定量的固體溶于水,配成相同濃度的溶液,測定其pH值,測定結果為Na2CO3、NaHCO3的pH分別為a和b(a、b均大于7)。
Ⅰ.測定溶液的pH值所用的主要儀器有:pH試紙、表面皿、 和標準比色卡。
Ⅱ.有關①100mL0.1 mol·L-1NaHCO3、②100mL0.1 mol·L-1Na2CO3兩種溶液的敘述不正確的是( )
| A.溶液中水電離出的OH-個數:②>① | B.溶液中陰離子的物質的量濃度之和:②>① |
| C.①溶液中:c(CO32-)>c(H2CO3) | D.②溶液中:c(HCO3-)>c(H2CO3) |
1.C 2.A、C 3.D 4.C 5.B、D 7.AB 8.C 9.A 10.AD 11.CD
12.B 13.C 14.C 15.C 16.C 17.D 18.C 19.D 20.C 21.D 22.B
23.本題考查學生稱量、加熱、溶解、結晶等基本操作,同時要求理論聯系實際確定有關化學方程式和計算溶解度.
通過計算知:用50 mL 70℃熱水與24 gKCl制幾乎飽和的溶液,再用25 mL 70℃熱水與 配制成飽和溶液,將此兩種溶液混合、攪勻、靜止、冷卻,將陸續析出
配制成飽和溶液,將此兩種溶液混合、攪勻、靜止、冷卻,將陸續析出 晶體,至20℃時,減壓過濾使
晶體,至20℃時,減壓過濾使 分離出來.
分離出來.
24.(1)無機酸酯

(2)X可能是沸石(或碎瓷片);防止暴沸
(3)回流冷凝易揮發的反應物:a;b
(4)用足量水洗滌,分液除去乙醇,加稀NaOH溶液,分液除去碘.
25.(1)C→B→D→A→G→H→E→F
(2)使漏斗下端管口緊靠燒杯內壁;及時關閉活塞,不要讓上層液體流出;使漏斗內外空氣相通以保證(G)操作時漏斗里液體能夠流出.
(3) 與水不互溶;而且碘在
與水不互溶;而且碘在 中的溶解度比在水中大很多.
中的溶解度比在水中大很多.
(4)A、C
提示:(4)熱裂汽油中含有不飽和氣態烴如丙烯、丁烯與溴發生加成反應.
26.(1)AEF (2)AB (3)AF(或AEF) (4)D (5)安全瓶防止堿液倒吸
27.(1)4 a、d、f、h h吸收 吸收
吸收 天平
天平
(2)試樣質量=碳元素質量+氫元素質量為烴
試樣質量>碳元素質量+氫元素質量為烴的含氧衍生物
(3)B
28.(1)
(2)堿石灰;無水 只能吸水,不能吸收
只能吸水,不能吸收 .
.
(3) (或
(或 )
)
(4) ;放熱;反應開始后斷開電鍵K,鉑絲能繼續保持紅熱.
;放熱;反應開始后斷開電鍵K,鉑絲能繼續保持紅熱.
(5)氣體顏色變淺; 發生反應:
發生反應:

 ,屬于放熱反應,達到平衡后,若降低溫度,平衡向右移動,
,屬于放熱反應,達到平衡后,若降低溫度,平衡向右移動, 濃度減少,
濃度減少, 濃度增大,而
濃度增大,而 無色,所以氣體顏色變淺.
無色,所以氣體顏色變淺.
29.本題考查學生乙炔的制取方法、干燥、氧化原理及產物的吸收測定順序.由于制得的乙炔氣含水對燃燒及產物測定有影響,故制得的乙炔氣體必須先干燥,然后再進行題中的催化氧化,乃至測定產物的質量.所以(1)G、E、F、H、I、C、D、A
(2)吸收燃燒產生的 氣體;吸收產生的水蒸氣;吸收乙炔中的水蒸氣.
氣體;吸收產生的水蒸氣;吸收乙炔中的水蒸氣.
(3)

(4)
30.解析:過程如下:


答案:①將廢水過濾,目的是除去其中的懸浮泥沙等不溶物;
②往①的濾液中加入足量鋅粉,將其中的 置換出來;
置換出來;
③過濾②中的不溶物,濾出Ag和過量的鋅粉;
④往③的濾渣中加入過量的稀硫酸,使其中的鋅粉轉化為 而進入溶液;
而進入溶液;
⑤過濾,將④中沒溶解的Ag濾出回收;
⑥將③、⑤得到的濾液合并,蒸發濃縮,使 析出后回收.
析出后回收.
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com