
題目列表(包括答案和解析)



| ||
| △ |
| ||
| △ |
| ||
| △ |
| ||
| △ |
| 1 |
| 2 |
請回答下列問題:
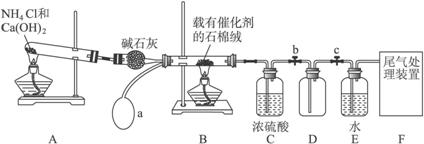
(1)寫出裝置A中主要反應的化學方程式______________________________________。
(2)已知1 mol NO2與液態水反應生成HNO3溶液和NO氣體放出熱量46 kJ,寫出該反應的熱化學方程式_______________________________________________________________。
該反應是一個可逆反應,欲提高NO2的轉化率,可采取的措施是___________________。
A.降低溫度 B.升高溫度
C.減小壓強 D.增大壓強
(3)實驗結束后,關閉止水夾b、c,將裝置D浸入冰水中,現象是___________________。
(4)裝置C中濃H2SO4的作用是_____________________________________________。
(5)請你幫助該化學小組設計實驗室制取NH3的另一方案____________________________。
(6)干燥管中的堿石灰用于干燥NH3,某同學思考是否可用無水氯化鈣代替堿石灰,并設計下圖所示裝置(儀器固定裝置省略未畫)進行驗證。實驗步驟如下:

①用燒瓶收集滿干燥的氨氣,立即塞上如圖所示的橡膠塞。
②正立燒瓶,使無水氯化鈣固體滑入燒瓶底部,搖動,可觀察到的現象是__________________,由此,該同學得出結論:不能用CaCl2代替堿石灰。
| |||||||||||||||||||||||||||||||||||||||
| ||
| ||
| ||
| ||
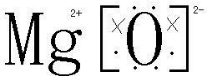
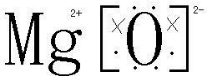
| 1 |
| 2 |
| 1 |
| 2 |
 A、B、C、D、E、F六種元素分屬三個短周期,且原子序數依次增大,A的原子在周期表中半 徑最小,A、D伺主族,可形成離子化合物DA;C、F同主族,可形成FC2,FC3兩種分子B,D,E 三者的最高價氧化物對應的水化物兩兩之間均可反應生成可溶性鹽和水,所得鹽中均含C元 素.請填寫下列空白:
A、B、C、D、E、F六種元素分屬三個短周期,且原子序數依次增大,A的原子在周期表中半 徑最小,A、D伺主族,可形成離子化合物DA;C、F同主族,可形成FC2,FC3兩種分子B,D,E 三者的最高價氧化物對應的水化物兩兩之間均可反應生成可溶性鹽和水,所得鹽中均含C元 素.請填寫下列空白:一、1.B 2.A?
3.解析:v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6。
答案:D?
4.BC 5.B 6.B 7.D 8.BD?
9.解析:由①②組數據解得m=1,由②③組數據解得n= 。
。
答案:D
二、10.(1)0.013 (2)1.0 催化劑 (3)> >
(4)吸熱 溫度升高時,平衡向右移動?
11.①
12.④>③=②>①?
13.
 (
( -x)?mol?L-1?min-1
-x)?mol?L-1?min-1
14.(1)1∶50 根據勒夏特列原理,通入過量而廉價的氧氣,可提高SO2的轉化率
(2)廢氣中每小時排出的SO2的體積為:1
(3)SO2 ~ 2NH3 ~ (NH4)2SO4?
 mol?
mol?
 mol
mol
 mol
mol
故可得(NH4)2SO4: mol×1
mol×1
消耗氨氣: mol×2×1
mol×2×1
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com