
題目列表(包括答案和解析)
已知2A(g)+B(g)![]() 2C(g),向容積為1L的密閉容器中加入0.050 mol A和0.025mol B,在500℃時充分反應,達平衡后測得c(C)=0.040 mol·L-1,放出熱量Q1kJ。
2C(g),向容積為1L的密閉容器中加入0.050 mol A和0.025mol B,在500℃時充分反應,達平衡后測得c(C)=0.040 mol·L-1,放出熱量Q1kJ。
(1)能說明上述反應已經達到化學平衡狀態的是 (填寫序號);
a.v(C)=2v(B) b.容器內壓強保持不變
c.v逆(A)=2v正(B) d.容器內氣體的密度保持不變
(2)若在相同的容器中只加入0.050 mol C,500℃時充分反應達平衡后,吸收熱量Q2kJ,則Q1與Q2之間的關系式可表示為 (用含Q1、Q2的代數式表示);
(3)500℃時,上述反應的化學平衡常數K= ;
(4)已知:K(300℃)>K(350℃),該反應是 (填“放”或“吸”)熱反應;若反應溫度升高,A的轉化率 (填“增大”、“減小”或“不變”);
(5)某溫度下,A的平衡轉化率(a)與體系總壓強(P)的關系如圖所示,平衡狀態由a變到b時,化學平衡常數K(A) K(B)(填“>”、“<”或“=”)。

(12分)已知2A(g)+B(g)2C(g),向容積為1L的密閉容器中加入0.050 mol A和0.025mol B,在500℃時充分反應,達平衡后測得c(C)=0.040 mol·L-1,放出熱量Q1kJ。
(1)能說明上述反應已經達到化學平衡狀態的是 (填寫序號);
a.v(C)=2v(B)
b.容器內壓強保持不變
c.v逆(A)=2v正(B)
d.容器內氣體的密度保持不變
(2)若在相同的容器中只加入0.050 mol C,500℃時充分反應達平衡后,吸收熱量Q2kJ,則Q1與Q2之間的關系式可表示為 (用含Q1、Q2的代數式表示);
(3)500℃時,上述反應的化學平衡常數K= ;
(4)已知:K(300℃)>K(350℃),該反應是 (填“放”或“吸”)熱反應;若反應溫度升高,A的轉化率 (填“增大”、“減小”或“不變”);
(5)某溫度下,A的平衡轉化率(a)與體系總壓強(P)的關系如圖所示,平衡狀態由a變到b時,化學平衡常數K(A) K(B)(填“>”、“<”或“=”)。
已知2A(g)+B(g)2C(g),向容積為1L的密閉容器中加入0.050 mol A和0.025mol B,在500℃時充分反應,達平衡后測得c(C)=0.040 mol·L-1,放出熱量Q1kJ。
(1)能說明上述反應已經達到化學平衡狀態的是 (填寫序號);
a.v(C)=2v(B) b.容器內壓強保持不變
c.v逆(A)=2v正(B) d.容器內氣體的密度保持不變
(2)若在相同的容器中只加入0.050 mol C,500℃時充分反應達平衡后,吸收熱量Q2kJ,則Q1與Q2之間的關系式可表示為 (用含Q1、Q2的代數式表示);
(3)500℃時,上述反應的化學平衡常數K= ;
(4)已知:K(300℃)>K(350℃),該反應是 (填“放”或“吸”)熱反應;若反應溫度升高,A的轉化率 (填“增大”、“減小”或“不變”);
(5)某溫度下,A的平衡轉化率(a)與體系總壓強(P)的關系如圖所示,平衡狀態由a變到b時,化學平衡常數K(A) K(B)(填“>”、“<”或“=”)。
已知2A(g)+B(g) 2C(g),向容積為1L的密閉容器中加入0.050 mol A和0.025mol B,在500℃時充分反應,達平衡后測得c(C
2C(g),向容積為1L的密閉容器中加入0.050 mol A和0.025mol B,在500℃時充分反應,達平衡后測得c(C )="0.040" mol·L-1,放出熱量Q1kJ。
)="0.040" mol·L-1,放出熱量Q1kJ。
(1)能說明上述反應已經達到化學平衡狀態的是 (填寫序號);
a.v(C)="2v(B) " b.容器內壓強保持不變
c.v逆(A)=2v正(B) d.容器內氣體的密度保持不變
(2)若在相同的容器中只加入0.050 mol C,500℃時充分反應達平衡后,吸收熱量Q2kJ,則Q1與Q2之間的關系式可表示為 (用含Q1、Q2的代數式表示);
(3)500℃時,上述反應的化學平衡常數K= ;
(4)已知:K(300℃)>K(350℃),該反應是 (填“放”或“吸”)熱反應;若反應溫度升高,A的轉化率 (填“增大”、“減小”或“不變”);
(5)某溫度下,A的平衡轉化率(a)與體系總壓強(P)的關系如圖所示,平衡狀態由a變到b時,化學平衡常數K(A) K(B)(填“>”、“<”或“=”)。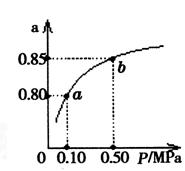
(12分)已知2A(g)+B(g) 2C(g),向容積為1L的密閉容器中加入0.050 mol A和0.025mol B,在500℃時充分反應,達平衡后測得c(C)="0.040" mol·L-1,放出熱量Q1kJ。
2C(g),向容積為1L的密閉容器中加入0.050 mol A和0.025mol B,在500℃時充分反應,達平衡后測得c(C)="0.040" mol·L-1,放出熱量Q1kJ。
(1)能說明上述反應已經達到化學平衡狀態的是 (填寫序號);
a.v(C)="2v(B) "
b.容器內壓強保持不變
c.v逆(A)=2v正(B)
d.容器內氣體的密度保持不變
(2)若在相同的容器中只加入0.050 mol C,500℃時充分反應達平衡后,吸收熱量Q2kJ,則Q1與Q2之間的關系式可表示為 (用含Q1、Q2的代數式表示);
(3)500℃時,上述反應的化學平衡常數K= ;
(4)已知:K(300℃)>K(350℃),該反應是 (填“放”或“吸”)熱反應;若反應溫度升高,A的轉化率 (填“增大”、“減小”或“不變”);
(5)某溫度下,A的平衡轉化率(a)與體系總壓強(P)的關系如圖所示,平衡狀態由a變到b時,化學平衡常數K(A) K(B)(填“>”、“<”或“=”)。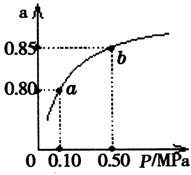
一、1.B 2.A?
3.解析:v(NH3)∶v(O2)∶v(NO)∶v(H2O)=4∶5∶4∶6。
答案:D?
4.BC 5.B 6.B 7.D 8.BD?
9.解析:由①②組數據解得m=1,由②③組數據解得n= 。
。
答案:D
二、10.(1)0.013 (2)1.0 催化劑 (3)> >
(4)吸熱 溫度升高時,平衡向右移動?
11.①
12.④>③=②>①?
13.
 (
( -x)?mol?L-1?min-1
-x)?mol?L-1?min-1
14.(1)1∶50 根據勒夏特列原理,通入過量而廉價的氧氣,可提高SO2的轉化率
(2)廢氣中每小時排出的SO2的體積為:1
(3)SO2 ~ 2NH3 ~ (NH4)2SO4?
 mol?
mol?
 mol
mol
 mol
mol
故可得(NH4)2SO4: mol×1
mol×1
消耗氨氣: mol×2×1
mol×2×1
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com