
題目列表(包括答案和解析)
工業制硝酸的主要反應為:4NH3(g)+5O2(g) 4NO(g)+6 H2O(g)△H。
4NO(g)+6 H2O(g)△H。
(1)已知氫氣的燃燒熱為285.8 kJ/mol。
N2(g)+3H2(g)=2NH3(g)? △H=-92.4 kJ/mol;
H2O(1)=H2O(g)△H=+44.0 kJ/mol;
N2(g)+O2(g)=2NO(g)△H=+180.6 kJ/mol。
則上述工業制硝酸的主要反應的△H=???????????????????????? 。
(2)在容積固定的密閉容器中發生上述反應,容器內部分物質的物質的量濃度如下表:

①反應在第2 min到第4 min時,O2的平均反應速率為?????????????????? 。
②反應在第6 min時改變了條件,改變的條件可能是????????? (填序號)。
A.使用催化劑????? B.升高溫度? C.減小壓強????? D.增加O2的濃度
③下列說法中能說明4NH3(g)+5O2(g) 4NO(g)+6 H2 O(g)達到平衡狀態的是??????? (填序號)。
4NO(g)+6 H2 O(g)達到平衡狀態的是??????? (填序號)。
A.單位時間內生成n mol NO的向時,生成n mol NH3
B.條件一定,混合氣體的平均相對分子質量不再變化
C.百分含量w(NH3)=w(NO)
D.反應速率v(NH3):u(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒溫恒壓下容積可變的容器中反應,混合氣體的密度不再變化
(3)某研究所組裝的CH3OH-O2燃料電池的工作原理如圖所示。

①該電池工作時,b口通入的物質為____????? 。
②該電池正極的電極反應式為:???????????????????????? 。
③以此電池作電源,在實驗室中模擬鋁制品表面“鈍化”處理(裝置如圖所示)的過程中,發現溶液逐漸變渾濁并有氣泡產生,其原因可能是?????????????????????????????????? (用相關的離子方程式表示)。

工業制鈦白粉產生的廢液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可利用酸解法生產補血劑乳酸亞鐵。其生產流程如下:
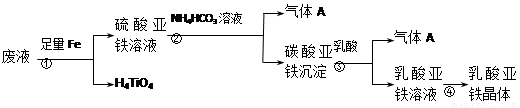
已知:TiOSO4可溶于水,在水中電離為TiO2+和SO42-。請回答下列問題:
(1)寫出TiOSO4水解生成鈦酸H4TiO4的離子方程式 。步驟①中加入足量鐵屑的目的是 。
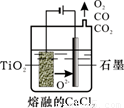
(2)工業上由H4TiO4可制得鈦白粉TiO2。TiO2直接電解還原法(劍橋法)生產鈦 是一種較先進的方法,電解質為熔融的CaCl2,原理如圖所示,陰極的電極反應為_______________。
(3)步驟②的離子方程式是 ,所得副產品主要 是__________(填化學式)。
(4)步驟④的結晶過程中必須控制一定的真空度,原因是 。
(5)乳酸可由乙烯經下列步驟合成:
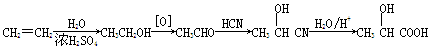
上述合成路線的總產率為60%,乳酸與碳酸亞鐵反應轉化為乳酸亞鐵晶體的產率為90%,則生產468 kg乳酸亞鐵晶體(M=234 g/mol)需要標準狀況下的乙烯 m3。
工業制鈦白粉產生的廢液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可利用酸解法生產補血劑乳酸亞鐵。其生產流程如下:
已知:TiOSO4可溶于水,在水中電離為TiO2+和SO42-。請回答下列問題:
(1)寫出TiOSO4水解生成鈦酸H4TiO4的離子方程式 。步驟①中加入足量鐵屑的目的是 。
(2)工業上由H4TiO4可制得鈦白粉TiO2。TiO2直接電解還原法(劍橋法)生產鈦 是一種較先進的方法,電解質為熔融的CaCl2,原理如圖所示,陰極的電極反應為_______________。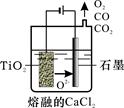
(3)步驟②的離子方程式是 ,所得副產品主要 是__________(填化學式)。
(4)步驟④的結晶過程中必須控制一定的真空度,原因是 。
(5)乳酸可由乙烯經下列步驟合成:
上述合成路線的總產率為60%,乳酸與碳酸亞鐵反應轉化為乳酸亞鐵晶體的產率為90%,則生產468 kg乳酸亞鐵晶體(M=234 g/mol)需要標準狀況下的乙烯 m3。
工業制硝酸的主要反應為:4NH3(g)+5O2(g) 4NO(g)+6 H2O(g)△H。
4NO(g)+6 H2O(g)△H。
(1)已知氫氣的燃燒熱為285.8 kJ/mol。
N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ/mol;
H2O(1)=H2O(g)△H=+44.0 kJ/mol;
N2(g)+O2(g)=2NO(g)△H=+180.6 kJ/mol。
則上述工業制硝酸的主要反應的△H= 。
(2)在容積固定的密閉容器中發生上述反應,容器內部分物質的物質的量濃度如下表: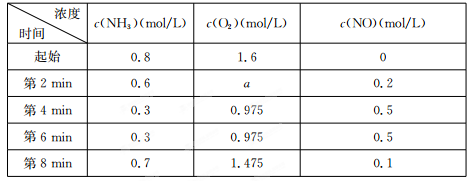
①反應在第2 min到第4 min時,O2的平均反應速率為 。
②反應在第6 min時改變了條件,改變的條件可能是 (填序號)。
A.使用催化劑 B.升高溫度 C.減小壓強 D.增加O2的濃度
③下列說法中能說明4NH3(g)+5O2(g) 4NO(g)+6 H2 O(g)達到平衡狀態的是 (填序號)。
4NO(g)+6 H2 O(g)達到平衡狀態的是 (填序號)。
A.單位時間內生成n mol NO的向時,生成n mol NH3
B.條件一定,混合氣體的平均相對分子質量不再變化
C.百分含量w(NH3)=w(NO)
D.反應速率v(NH3):u(O2):v(NO):v(H2O)=4:5:4:6
E.若在恒溫恒壓下容積可變的容器中反應,混合氣體的密度不再變化
(3)某研究所組裝的CH3OH-O2燃料電池的工作原理如圖所示。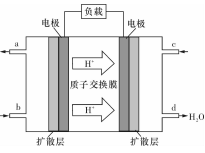
①該電池工作時,b口通入的物質為____ 。
②該電池正極的電極反應式為: 。
③以此電池作電源,在實驗室中模擬鋁制品表面“鈍化”處理(裝置如圖所示)的過程中,發現溶液逐漸變渾濁并有氣泡產生,其原因可能是 (用相關的離子方程式表示)。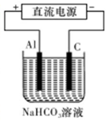
工業制純堿的第一步是通過飽和食鹽水、氨和二氧化碳之間的反應,制取碳酸氫鈉晶體。該反應原理可以用以下化學方程式表示,此反應是放熱反應。
NH3 + CO2 + H2O + NaCl(飽和) ![]() NaHCO3(晶體)↓+ NH4Cl
NaHCO3(晶體)↓+ NH4Cl
(1)某校學生實驗小組利用上述反應原理,設計如圖所示裝置,制取碳酸氫鈉晶體。C燒杯中盛有冰水,D中裝有蘸稀硫酸的脫脂棉,圖中夾持裝置已略去。
可選用的藥品有:a.石灰石 b.生石灰 c.6 mol/L鹽酸 d.稀硫酸 e.濃氨水
f.飽和氯化鈉溶液。

①A中制備氣體時,所需藥品是(選填字母代號) ;
②B中盛有飽和碳酸氫鈉溶液,其作用是 ;
③在實驗過程中,向C中通入氣體是有先后順序的,應先通入氣體的化學式為 ;
④檢驗D出口處是否有氨氣逸出的方法是 。
(2)該小組同學為了測定C中所得晶體的碳酸氫鈉的純度(假設晶體中不含碳酸鹽雜質),將晶體充分干燥后,稱量質量為wg。再將晶體加熱到質量不再變化時,稱量所得粉末質量為mg。然后進行如圖所示實驗:

①在操作II中,為了判斷加入氯化鈣溶液是否過量,其中正確的是(選填字母序號) ;
A.在加入氯化鈣溶液后,振蕩、靜置,向溶液中繼續加入少量氯化鈣溶液
B.在加入氯化鈣溶液后,振蕩、靜置,向溶液中再加入少量碳酸鈉溶液
C.在加入氯化鈣溶液后,振蕩、靜置,取上層清液再加入少量碳酸鈉溶液
②操作III的方法為 、 、 ;
③所得晶體中碳酸氫鈉的純度為 。
例2.從某些性質看,NH3與H2O相當,NH4+與H3O+,NH2―與O2―都有相當關系,下列有關方程式不正確的是 ( )
A. NH4Cl+KNH2=KCl+2NH3↑
B. M+2NH3=M(NH2)2+H2↑(M為二價活潑金屬)
C. 2NH4Cl+MNH=MCl2+NH3
D. 2NH4Cl+MO=M(NH2)2+2HCl+H2O
解析:A中KNH2可看成KOH,反應正確,B中NH3可看成H2O,反應正確,C中MNH可看成MO,反應同樣也正確,而D中若將NH4Cl看成H3OCl即HCl,則有反應2NH4Cl+MO=MCl2+NH3↑+H2O
例 3.某化學課外小組所做實驗的示意圖如下圖
3.某化學課外小組所做實驗的示意圖如下圖
 圖中“ ”表示氣體流向,M是一種子純凈而干燥的氣體,Y為另一種氣體。當與M氣體反應時y氣體過量,E內有棕色氣體產生。實驗所用到的物質只能由下列物質中選取:Na2CO3、Na2O2 、NaCl、CaCl2、(NH4)2CO3堿石灰等固體及蒸鎦水。據此實驗,完成下列填空:
圖中“ ”表示氣體流向,M是一種子純凈而干燥的氣體,Y為另一種氣體。當與M氣體反應時y氣體過量,E內有棕色氣體產生。實驗所用到的物質只能由下列物質中選取:Na2CO3、Na2O2 、NaCl、CaCl2、(NH4)2CO3堿石灰等固體及蒸鎦水。據此實驗,完成下列填空:
(1) A中所用裝置的主要儀器有
(2)B中所選的干燥劑是 ,作用是 。
(3)C中發生的主要反應的化學方程式是
(4)制取y氣體的D裝置所用的主要儀器是
制取y的化學方程式是 。
(1)當F中為紫色石蕊試液時,見到的現象是 主要反應方程式為 、 。
解析:解此題抓住兩點:①產生C(或E)氣體的條件為Pt絲紅熱②E內有紅棕色即為NO2,得知M為NH3,y為O2,C中有NO、NO2、H2O(g)等。
答案:(1)大試管,鐵架臺(附鐵夾),酒精燈,單孔塞和玻璃管。
(2) 堿石灰,既除去水蒸氣又除去CO2.
 (3)4NH3+5O
(3)4NH3+5O
(4)平底燒瓶,分液漏斗,膠塞 ,導管(用錐形瓶代替平底燒瓶也可)
 2Na2O2 +2H2O
= 4NaOH + O2
2Na2O2 +2H2O
= 4NaOH + O2
(5)紫色石蕊試液變紅,3NO2+H2O=2HNO3+NO,HNO3=H++NO ?3。
例4在室溫時有50ml的混合氣體,它們可能由HCl、NH3、CO2、NO組成。將這些混合氣體通過濃H2SO4后體積減少為35ml ,再通過過量的過氧化鈉氣體體積又減少為20ml,最后將氣體通過水,充分反應后只剩下10ml 氣體。(所有氣體體積在同溫同壓下測定)求:
① 混合氣體由哪些氣體組成?它們的各占多少毫升?
② 最后剩余氣體是什么氣體?
解析:50ml混合氣體通過濃H2SO4體積減少為35ml,則NH3體積為50ml-35ml=15ml。由此確定無HCl。由題意可知還有CO2和NO。設含CO2為xml,NO為yml,若最后10ml為NO,則由:3NO2+H2O=2HNO3+NO可知需NO2為30ml>20ml,不合題意,若最后10ml為O2,則由4NO+3O2+2H2O=4HNO3可知ymlNO需消耗 ymlO2,再由2CO2+2Na2O2=2NaCO3+O2得生成O2為
ymlO2,再由2CO2+2Na2O2=2NaCO3+O2得生成O2為 ml,
ml, 解得
解得

則NH3為15ml,CO2為29ml,NO為6ml
答案:①混合氣體由29mlCO2,15mlNH3,6mlNO組成。②剩余氣體為O2,其體積為10ml.
例5 在密閉容器中,放入碳酸銨和氫氧化鈉固體共Ag,將容器加熱至
 解析:可能發生如下反應:
解析:可能發生如下反應:
(NH4)2CO2 + 2NaOH === 2NH3↑+ 2H2O + Na2CO3 ………①
(NH4)2CO3 === 2NH3↑+ CO2↑+ H2O↑……………………②
在加熱過程中應首先發生反應①,只有當(NH4)2CO3過量時才能繼續發生反應②。并由以上反應可以看出,NaOH過量時減重少,殘留固體只有兩種情況。一當(NH4)2CO3正好作用或過量時殘留物為Na2CO3,二當NaOH過量時殘留物為Na2CO3和NaOH的混合物,下面分別討論。
10據反應(NH4)2CO3 + 2NaOH === Na2CO3 + 2NH3↑+ 2H2O↑
 96 80
96 80
176 106 34 36
A B
當A/B=176/106即A= B時,兩者恰好反應
B時,兩者恰好反應

20當NaOH過量時,即A> B時,根據減少質量確定(NH4)2CO3質量
B時,根據減少質量確定(NH4)2CO3質量

30當(NH4)2CO3過量,即A< B時,殘留固體為Na2CO3,可確定參加反應的NaOH的質量。
B時,殘留固體為Na2CO3,可確定參加反應的NaOH的質量。


答案:(1)當(NH4)2CO3過量或正好作用時
(2)當NaOH過量時,

4.實戰演練
一、選擇題:
1、下列氣體中最易液化的是
A、N2 B、O
2、既能用濃硫酸,又能用堿石灰干燥的氣體是
A、Cl2 B、SO
3、下列物質中既能與稀硫酸反應,又能與燒堿溶液反應的是
A、NH4Cl B、NH4HS C、NaHCO3 D、FeS
4、下列各組物質的空間構型完全不同的是
A、NH3和H3O+ B、NH4+和CH4
C、CO2和SiO2 D、金剛石和晶體硅
5、下列各組氣體,在通常條件下能穩定共存的是
A、NH3、O2、HCl B、N2、H2、HCl
C、CO2、NO、O2 D、H2S、O2、SO2
6、某混合氣體可能有CO、CO2、NH3、HCl、H2和水蒸氣中的一種或幾種,當依次通過澄清石灰水(無渾濁現象),氫氧化鋇溶液(有渾濁現象)。濃H2SO4、灼熱的氧化銅(變紅)和無水硫酸銅(變藍)時,則可斷定該混合氣體中一定有
A、HCl、CO2、H2 B、CO、H2、H2O
C、CO、H2、NH3 D、HCl、CO、H2O
7、氨水中含氮的微粒最多的是
A、NH3 B、NH3?H2O C、NH4+ D、OH-
8、下列混合物可用加熱方法分離的是
A、碘和氯化銨 B、硫酸鉀和氯酸鉀
C、氯化銨和硫酸鋇 D、碳酸氫鈉和碳酸氫銨
9、限用一種試劑,經過一次性實驗就能鑒別Na2CO3、(NH4)2SO4、NH4Cl、KNO3溶液,應選用
A、AgNO3溶液 B、NaOH溶液
C、Ba(OH)2溶液 D、鹽酸
10、下列各組離子在水溶液中能大量共存的是
A、CO32-、H+、HCO3-、Ca2+ B、NH4+、OH-、Ba2+、NO3-
C、I-、ClO-、NO3-、H+ D、SO32-、SO42-、Na+、OH-
二、填空
11、A、B、C三種氣體,A為無色,在一定條件下A能與O2反應生成B;B不溶于水,它能與O2反應生成C;A、C氣體均溶于水,其水溶液分別呈堿性與酸性。推斷。A 、C 。
12、將aL含(NH4)2SO4與NH4NO3的混合液平均分成兩份,向一份中加入b mol燒堿,加熱恰好將其中NH3全部趕出,向另一份中加入BaCl2溶液完全反應。消耗c mol BaCl2,原溶液中NO3-的物質的量濃度為 。
三、計算
13、
350體積(標準狀況)的氨氣溶解在1體積的水里,求這種氨水的質量分數和物質的量濃度。(該氨水的密度為
【能力訓練答案】
一、選擇題
1、C 2、C 3、B C 4、C 5、B 6、A 7、B
8、C 9、C 10、D
二、填空
11、NH3、NO2
12、
三、計算
13、

湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com