
題目列表(包括答案和解析)
(1)在一定體積的密閉容器中,進行如下化學反應,CO2(g)+H2(g) CO(g)+H2O(g)。其化學平衡常數K與溫度t的關系如下。請回答下列問題:
CO(g)+H2O(g)。其化學平衡常數K與溫度t的關系如下。請回答下列問題:
|
t℃ |
700 |
800 |
830 |
1000 |
1200 |
|
K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
①該反應的化學平衡常數的表達式K = ,由上表數據可得,該反應為 反應。(填“吸熱”或“放熱”)
②800℃,固定容器的密閉容器中,放入混合物,其始濃度為c(CO)=0.01 mol·L-1、c(H2O)=0.03 mol·L-1、c(CO2)=0.01 mol·L-1、c(H2)=0.05 mol·L-1,則反應開始時,H2O的消耗速率比生成速率 (填"大"、"小"或"不能確定")
③830℃,在1 L的固定容器的密閉容器中放入2 mol CO2和1 mol H2,平衡后CO2的轉化率為 。
(2)目前工業上有一種方法是用CO2來生產燃料甲醇。為探究反應原理,現進行如下實驗,在體積為1L的密閉容器中,充入1mol CO2和3mol H2,在500℃下發生反應:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。測得CO2(g)和CH3OH(g)的濃度隨時間變化如圖所示:
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。測得CO2(g)和CH3OH(g)的濃度隨時間變化如圖所示:

①平衡時CH3OH的體積分數w為 。
②現在溫度、容積相同的3個密閉容器中,按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡時的有關數據如下。下列說法正確的是
|
容器 |
實驗1 |
實驗2 |
實驗3 |
|
反應物投入量(始態) |
1mol CO2、3mol H2 |
1mol CH3OH、1mol H2O |
2mol CH3OH、2mol H2O |
|
CH3OH的平衡濃度/mol·L-1 |
C1 |
C2 |
C3 |
|
反應的能量變化 |
放出 x kJ |
吸收y kJ |
吸收z kJ |
|
體系壓強/Pa |
P1 |
P2 |
P3 |
|
反應物轉化率 |
a1 |
a2 |
a3 |
A.2 C1>C3 B.x+y=49.0 C.2P2< P3
D.(a1+ a3)<1 E.2P1> P3 F.a1= a2
③在一個裝有可移動活塞的容器中進行上述反應:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。反應達到平衡后,測得CH3OH的物質的量為a mol,保持容器內的溫度和壓強不變,向平衡體系中通入少量的H2,再次達到平衡后,測得CH3OH的物質的量為b mol,請比較a、b的大小
。
CH3OH(g)+H2O(g)。反應達到平衡后,測得CH3OH的物質的量為a mol,保持容器內的溫度和壓強不變,向平衡體系中通入少量的H2,再次達到平衡后,測得CH3OH的物質的量為b mol,請比較a、b的大小
。
(1)在一定體積的密閉容器中,進行如下化學反應,CO2(g)+H2(g)![]() CO(g)+H2O(g)。其化學平衡常數K與溫度t的關系如下。請回答下列問題:
CO(g)+H2O(g)。其化學平衡常數K與溫度t的關系如下。請回答下列問題:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
①該反應的化學平衡常數的表達式K = ,由上表數據可得,該反應為 反應。(填“吸熱”或“放熱”)
②800℃,固定容器的密閉容器中,放入混合物,其始濃度為c(CO)=0.01 mol·L-1、c(H2O)=0.03mol·L-1、c(CO2)=0.01 mol·L-1、c(H2)=0.05 mol·L-1,則反應開始時,H2O的消耗速率比生成速率 (填"大"、"小"或"不能確定")
③830℃,在1 L的固定容器的密閉容器中放入2 mol CO2和1 mol H2,平衡后CO2的轉化率為 。
(2)目前工業上有一種方法是用CO2來生產燃料甲醇。為探究反應原理,現進行如下實驗,在體積為1L的密閉容器中,充入1mol CO2和3mol H2,在500℃下發生反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。測得CO2(g)和CH3OH(g)的濃度隨時間變化如圖所示:
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。測得CO2(g)和CH3OH(g)的濃度隨時間變化如圖所示:
①平衡時CH3OH的體積分數w為 。
②現在溫度、容積相同的3個密閉容器中,按不同方式投入反應物,保持恒溫、恒容,測得反應達到平衡時的有關數據如下。下列說法正確的是
| 容器 | 實驗1 | 實驗2 | 實驗3 |
| 反應物投入量(始態) | 1mol CO2、3mol H2 | 1mol CH3OH、1mol H2O | 2mol CH3OH、2mol H2O |
| CH3OH的平衡濃度/mol·L-1 | C1 | C2 | C3 |
| 反應的能量變化 | 放出 x kJ | 吸收y kJ | 吸收z kJ |
| 體系壓強/Pa | P1 | P2 | P3 |
| 反應物轉化率 | a1 | a2 | a3 |
A.2 C1>C3 B.x+y=49.0 C.2P2<P3
D.(a1+a3)<1 E.2P1>P3 F.a1= a2
③在一個裝有可移動活塞的容器中進行上述反應:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。反應達到平衡后,測得CH3OH的物質的量為a mol,保持容器內的溫度和壓強不變,向平衡體系中通入少量的H2,再次達到平衡后,測得CH3OH的物質的量為b mol,請比較a、b的大小 。
CH3OH(g)+H2O(g)。反應達到平衡后,測得CH3OH的物質的量為a mol,保持容器內的溫度和壓強不變,向平衡體系中通入少量的H2,再次達到平衡后,測得CH3OH的物質的量為b mol,請比較a、b的大小 。
以下是某些主族元素的半徑和化合價:
| 元素 | N | O | F | P | X | Y |
| 原子半徑(nm) | 0.075 | 0.074 | 0.071 | 0.110 | r(X) | r(Y) |
| 最高(低)化合價 | ―3 +5 | ―2 | ―1 | ―3 | ―2 +6 | ―1 +7 |
(1)若0.110>r(x)>0.074,則X元素為 (填元素符號,下同),若r(Y)為0.114nm,且通常情況下Y單質為液體,則Y元素為 ;
(2)比較穩定性:HF HY(填“>”“<”);比較穩定性;若毒性有PH3>NH3,,H2S>H2則CY4 CF4;(填“>”或“<”)
(3)已知XO2具有漂白性,Z與X同周期、與Y同主族,Z單質的水溶液也具有漂白性,將等物質的量的XO2和Z2通入水中,該溶液 (填“具有”,或“不具有”)漂白性;若反應后所得溶液與400mL1mol/LNaOH溶液恰好完全反應,則XO2的物質的量為 ;Z元素與上表中的P元素形成的一種化合物,化合物中所有原子都滿足8電子穩定結構,該化合物的化學式是 ;此化合物分子的空間構型為 。
X、Y、Z、R 四種短周期元素,原子序數依次增大。已知:X、R處于同一主族,Y元素的最高正價和最低負價的絕對值相等,X與Y元素形成的一種物質是天然氣的主要成分;Y與Z元素形成的一種氣體會使大氣產生“溫室效應”。
請回答下列問題:
(1)X、Y、Z三元素所形成的單質或化合物之間,可按下圖裝置組成燃料電池。
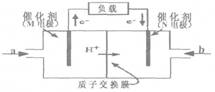
若b口通入的是氣體Z2,則a口通入的物質可以是 、 、 (分別填寫只由一種、兩種、三種元素組成的物質,用化學式表示);M電極的名稱為 (填“正極”、“負極”或“陰極”、“陽極”);N電極的電極反應式為 (用化學式表示)。
(2)日常生活中我們經常用到的一種物質其主要成分的化學式為Y18X35Z2R,這種物質的學名為 ,制造這種物質的反應叫 ,寫出該反應的化學方程式 。
(3)合成氨工業中,原料氣制備的其中一個反應為:YZ+X2Z(g)![]() YZ2+X2;
YZ2+X2;
已知該反應化學平衡常數K和溫度T的關系如下表:
| T(℃) | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
則下列有關的敘述正確的是 。
A.該反應![]() <0
<0
B.若絕熱時(容器內外沒有熱量交換),改變某一條件平衡向逆反應方向移動,剛容器內氣體的溫度一定升高
C.若反應在830℃的溫度達到平衡狀態,反應容器內的四種物質的濃度則一定相等
D.該反應在某溫度下,YZ、X2Z的物質的量濃度與時間的關系如下圖所示,據此可計算得YZ的轉化率為80%

湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com